
신약 개발, 생명원리 규명 등 적용 기대
Butane-1,2,3,4-tetraol-based amphiphilic stereoisomers for membrane protein study: importance of chirality in the linker region

질병을 치료할 수 있는 약물분자의 주요 타깃인 세포막단백질*의 구조를 분석할 수 있는 새로운 방법이 제시되었다.
*세포막 단백질 : 세포막에 존재하여 세포외부에서 오는 신호 및 물질을 세포내로 전달해주는 역할을 함.
한국연구재단(이사장 조무제)은 채필석 교수(한양대) 연구팀이 세포막 단백질* 구조 분석을 위한 새로운 화학적 도구로 물과 기름에 모두 친한 양친매성*의 성격을 가진 화합물을 개발했다고 밝혔다.
*양친매성(amphiphilic): 물에 친한 친수성기와 물과 친하지 않는 소수성기를 동시에 갖고 있는 화합물이 갖고 있는 특성
세포막 단백질의 3차 구조를 원자 수준으로 규명하는 것은 신약을 개발하거나 생명현상의 원리를 근본적으로 이해하는데 필수다. 현재 세포막 단백질의 구조를 규명하는데 활용되는 양친매성 분자는 약 100가지 이상이고, 단백질의 특성에 따라 이에 맞는 양친매성 분자가 필요하다. 연구팀이 주목한 양친매성 분자는 포유동물 유래의 세포막 단백질처럼 구조적으로 불안정하여 안정성을 확보하기 어려운 단백질 구조분석에 매우 효과적이다.
연구팀은 두 개의 키랄 중심*을 갖는 양친매성 분자를 개발하여 양친매성 분자의 입체화학*을 정교하게 제어함으로써 막단백질 안정화 능력을 크게 향상시켰다. 단백질의 안정성 확보는 성공적인 단백질 3차 구조 및 기능 규명을 위해 가장 중요한 요소이다. 결과적으로 양친매성 분자의 입체화학적 구조변화가 막단백질의 구조 안정화에 얼마나 중요한 영향을 끼치는지에 대한 정확한 결과를 제시함으로써 양친매성 분자의 중요한 설계원리를 제공할 수 있게 되었다.
*키랄 중심(chirality center) : 한 원소 주위에 다른 4개의 치환기가 붙어있을 때 그 중심원자를 키랄 중심이라고 하고 분자의 광학 활성을 나타내는 근원이 됨.
*입체화학(stereochemistry) : 분자의 3차원적 구조 또는 그를 밝히는 방법론과 거기에 유래되는 물성론을 포함하는 학문 영역
채필석 교수는 “이 연구 성과는 양친매성 분자의 입체화학을 정교하게 제어하여 막단백질의 안정화 효과를 극대화한 최초의 연구다. 향후 신약개발의 주요 타깃이 되는 세포막 단백질에 대한 3차 구조 정보를 확보하는데 기여하고, 또한 세포에서 일어나는 다양한 신호 전달 과정에 대한 보다 근원적인 정보를 제공해 줄 수 있을 것으로 기대된다”라고 연구의 의의를 설명했다.
이 연구 성과는 미래창조과학부 기초연구사업(개인연구), 선도연구센터 지원사업의 지원으로 수행되었으며, 세계적인 학술지 케미컬 사이언스 (Chemical Science) 10월 5일자에 게재되었다.
논문의 주요 내용
□ 논문명, 저자정보
- 논문명 : Butane-1,2,3,4-tetraol-based amphiphilic stereoisomers for membrane protein study: importance of chirality in the linker region
- 저자 정보 : 채필석 (한양대학교 ERICA, 교신저자), 마나벤드라 다스 (한양대학교 ERICA, 제1저자), 베네디테 버네 (영국 임페리얼 칼리지 대학, 공동저자), 브라이언 코빌카 (미국 스탠포드 대학, 공동저자), 클라우스 로랜드 (덴마크 코펜하겐 대학, 공동저자), 랜 구안 (미국 텍사스텤 대학, 공동저자), 양 두 (미국 스탠포드 대학, 공동저자), 조나스 모텐슨 (덴마크 코펜하겐 대학, 공동저자), 오르퀴디어 리베이로 (영국 임페리얼 칼리지 대학, 공동저자) 파라메스와란 하리하란 (미국 텍사스텤 대학, 공동저자).
□ 논문의 주요 내용
1. 연구의 필요성
막단백질의 3차 구조를 원자 수준으로 분석하는 일은 신약을 개발하고 생명원리를 규명하는데 매우 유용하기 때문에 많은 연구자들이 큰 관심을 갖고 있다. 2012년 노벨화학상도 신약개발의 주요 타깃이 되는 G-단백질 연결 수용체*의 복합구조를 규명한 연구자들 (Brian Kobilka와 Robert Lefkowitz)이 수상하였다. 이러한 세포막에 존재하여 중요한 기능을 하는 막단백질들의 구조를 분석하는데 필수적으로 사용되는 화학적 툴이 바로 양친매성 분자이다. 이 양친매성 분자는 막단백질의 소수성 표면에 들러붙어 막단백질 표면을 친수성으로 바꿔줌으로써 물에 잘 녹는 단백질로 만들어준다.
*G-단백질연결수용체(G protein-coupled receptor) : 세포막에 존재하면서 특정 호르몬과 G-단백질이 결합하여 활성화 상태가 되고 이 활성화 상태의 단백질은 호르몬에 해당하는 신호를 세포내에 전달하는데 중추적 역할을 하는 세포막 단백질.
전통적인 양친매성 분자들에 의해 둘러싸인 세포막 단백질은 시간이 지남에 따라 변성 또는 응집이라는 과정을 거쳐 그 구조가 무너져 핵자기 공명이나 X-선 회절을 통한 그 구조분석이 어려웠다. 따라서 이와 같은 문제점을 해결하기 위해서는 막단백질의 3차 구조를 장시간 안정하게 보존할 수 있는 새로운 양친매성 분자가 필요하다. 이에 많은 연구자들이 새로운 양친매성 분자를 개발해왔지만 분자 내에 키랄 중심*을 도입하여 그 입체화학을 제어함으로써 막단백질의 안정화 효과를 체계적으로 분석한 연구는 전무후무하다. 이에 이 연구는 양친매성 분자 구조 내에 두 개의 키랄 중심을 지닌 BTM이라 불리는 양친매성분자 9종을 합성하여 양친매성분자의 입체화학에 따른 세포막 단백질 안정화 효과를 체계적으로 분석하였다.
*키랄 중심(chirality center) : 한 원소 주위에 다른 4개의 치환기가 붙어있을 때 그 중심원자를 키랄 중심이라고 하고 분자의 광학 활성을 나타내는 근원이 됨.
2. 연구 내용
새로운 분자는 두개의 탄수화물 친수성기와 두개의 알킬체인 소수성기를 부탄-1,2,3,4-테트라올 (butane-1,2,3,4-tetraol (BT)) 연결고리로 연결한 양친매성을 갖는 화합물이고 이 양친매성 분자를 BTM이라 명명하였다. 두개의 소수성기를 BT연결고리와 연결할 때 두 개의 탄소가 키랄성*을 갖게 되어 같은 소수성기와 친수성기를 갖는 3종의 입체이성질체를 얻을 수 있었고 이를 각각 A-, B- 그리고 M-BTM이라 명명하였다. 또한 알킬사슬의 길이를 C9, C10, C11로 변화를 주어 세포막 단백질의 변성 및 응집을 최소화하는 최적 길이의 알킬사슬을 모색하였다. 결과적으로 9종의 BTM 양친매성 분자를 설계 및 합성하였고 이를 4개의 세포막 단백질에 대해서 평가하였다.
*키랄성(chirality) : 한 원소 주위에 다른 4개의 치환기가 결합하여 화합물의 거울상이미지와 원래 이미지가 달라지게 되는 성질
여기에서 사용된 단백질들은 모두 구조안정화에 도전적인 세포막단백질로 신약 개발의 주요 타깃인 G-단백질연결수용체의 한 종류인 아드레날린 수용체를 포함하고 있다. 평가 결과 테스트한 모든 단백질에 대해서 M-BTM 입체이성질체가 다른 입체이성질체들보다 단백질 안정화 능력이 탁월하였고 M 입체이성질체는 현재 가장 널리 사용되는 도데실말토사이드 (DDM)* 보다도 월등히 그 특성이 우수하였다.
*도데실말토사이드(dodecyl maltoside (DDM)) : 120개 이상의 전통적인 양친매성 분자 중 세포막 단백질 연구에 가장 널리 사용되고 있는 화합물로 소수성기와 친수성기로 각 각 도데실 사슬과 말토오즈를 지님.
이는 분자의 키랄성을 잘 제어하면 같은 화학식과 같은 배열을 갖는 양친매성 분자라 하더라도 막단백질 안정화 특성이 매우 달라질 수 있음을 의미하여 시사하는 바가 크다. 또한 M-BTM 입체 이성질체가 특별히 우수한 특성을 나타내는 원인을 양친매성 분자의 기하학적 구조 분석을 통해 성공적으로 해석함으로써 앞으로 분자의 입체화학을 이용해 양친매성 분자를 설계할 때 매우 중요한 원리를 제공한다.
3. 연구 성과
우리 몸에는 10만개 이상의 세포막 단백질이 존재하며 이들의 구조와 특성은 매우 다양하다. 이처럼 다양한 막단백질의 3차 구조를 원자수준으로 규명하기 위해서는 단백질의 특성과 매치가 되는 양친매성 분자의 발굴이 선행되어야 한다. 이 연구에서 발굴한 BTM이라는 화학적 툴은 그 특성의 우수성과 제조의 용이성으로 이와 같이 도전적인 막단백질의 3차 구조를 규명하는데 유용하게 사용될 것으로 기대된다.
다양한 세포막 단백질을 위해서는 다수의 양친매성 분자의 개발이 요구된다. 하지만 현재 양친매성 분자의 설계 원리의 부족으로 막단백질 연구에 효과적인 양친매성 분자 개발은 매우 느리게 진행되고 있다. 여기서 제시한 분자 설계원리는 앞으로 탁월한 특성을 지닌 양친매성 분자를 설계 및 개발하는데 중요한 밑거름이 될 것이고 다수의 우수한 양친매성 분자가 개발되면 막단백질 구조분석이 용이해져 신약개발과 생명현상 이해의 수월성을 획기적으로 증진시킬 수 있다.
연구팀이 개발한 BTM은 현재 국제 특허 (PCT) 출원을 마쳤으며 미국 소재 회사인 아반티(Avanti)와 독점 계약을 통한 기술이전을 협의 중에 있어 우수한 BTM 분자들은 조만간 상용화될 것으로 예상된다.
연 구 결 과 개 요
1. 연구배경
세포막에 존재하는 막단백질은 물질 및 신호전달 그리고 세포 간 커뮤니케이션이라는 아주 중요한 기능을 맡고 있어 약물의 주요 타깃이 된다. 하지만 그 3차 구조의 규명은 매우 도전적이라서 전체 세포막 단백질 중 약 1% 정도만이 그 구조가 알려져 있는 실정이다.
세포막 단백질 구조 및 기능 연구에 양친매성 분자라고 알려진 화합물들이 필수적인 툴로 사용되는데 그 이유는 이 분자들이 물에 녹지 않는 막단백질의 주위를 에워싸서 그 소수성 표면을 친수성으로 변환하여 수용성으로 만들어주고 그 구조를 안정화시켜주기 때문이다.
전통적인 양친매성 분자들은 막단백질에 대한 특성이 제한적이라서 소수의 비교적 안정한 막단백질의 구조 연구에는 성공적으로 사용되어 왔지만 구조적으로 불안정한 막단백질의 연구에는 무용지물이라서 최근 새로운 종류의 양친매성 분자들이 많이 개발되어 왔다. 하지만 양친매성 분자의 입체화학적 특성이 막단백질 구조적 안정화에 미치는 연구를 체계적으로 수행한 예는 선례가 없다.
2. 연구내용
연구팀에서는 2-부텐-1, 4-디올을 출발물질로 하여 두 개의 소수성 알킬사슬과 두 개의 친수성 탄수화물을 순차적으로 도입하여 소수성기와 친수성기가 동시에 존재하는 BTM 양친매성 분자를 합성하였다. 두 가지 다른 입체화학을 갖는 출발물질로부터 3개의 다른 입체화학을 갖는 키랄성 BTM을 4단계의 합성과정을 거쳐 제조하였고 이들 중 M-입체 이성질체가 합성이 가장 용이했고 가장 큰 마이셀*을 형성했으며 가장 작은 임계마이셀농도*를 보여주었다. 주목할 만한 점은 M-BTM의 소수성 부분은 다른 BTM분자들의 소수성 부분과 부분입체이성질체* 관계에 있고 A-와 B-BTM 소수성 부분들은 서로 광학이성질체* 관계에 있다.
* 마이셀 (micelle) : 양친매성 분자가 수용액에 녹을 때 형성되는 둥근형태의 자가조립구조
* 임계마이셀농도 (critical micelle concentration) : 수용액에서 마이셀이 형성되기 시작하는 양친매성 분자의 농도
* 부분입체이성질체 : 키랄중심을 갖고 있지만 서로 거울상이 아닌 이성질체.
* 광학이성질체 : 키랄중심을 갖고 있으면서 서로 거울상인 이성질체.
새로운 양친매성 분자의 우수성을 증명하기 위해서는 적어도 3개 이상의 다른 세포막 단백질에 대해서 평가를 해야 한다. 이는 앞서 기술했듯 막단백질의 구조와 특성은 그 종류에 따라 천차만별이기 때문에 특정 타깃 막단백질에 대해서 우수한 특성을 갖는 양친매성 분자가 타 막단백질들에 대해서는 전혀 우수하지 않을 수 있기 때문이다. 따라서 새로운 양친매성 분자의 우수성을 객관적으로 평가하기 위해서는 가능한 한 많은 단백질에 대해 그 일반적인 우수성을 입증해야 한다.
제조한 9종의 BTM 양친매성 분자를 먼저 UapA라는 진핵생물 유래의 세포막 단백질의 안정성에 대해 평가하였다. 단백질의 안정성은 각각의 양친매성 분자에 의해 용해되어 있는 단백질 샘플을 40도에서 10분간 열처리 후 크기배제 크로마토그래피*을 통해 UapA단백질의 균일성을 분석함으로써 평가하였다. 그 결과 M-입체이성질체가 다른 입체이성질체보다 우수하였고 그 중에서도 C11 알킬 사슬 길이를 갖고 있는 M-BTM-C11이 가장 우수한 특성을 보여 주었다.
* 크기배제크로마토그래피 (size exclusion chromatography) : 여러 분자가 혼합되어 있는 혼합물을 그 크기별(분자량별)로 분류해주는 분석 방법. 분자량이 작은 것은 컬럼에서 천천히 나오고 분자량이 큰 것들은 빨리 나옴.
새로운 양친매성 분자를 원핵생물 유래의 LeuT 단백질에 대해 평가하였는데 이 단백질은 아미노산 중 루신을 세포 내로 수송하는 단백질이다. 이 단백질이 leucine에 결합하는 능력을 측정하여 단백질의 안정성을 평가하였고 그 결과 C10의 알킬사슬 길이를 갖는 BTM-C10이 DDM보다 월등히 우월한 막단백질 안정화 효과를 보여주었다. BTM-C10의 세개의 입체이성질체는 모두 매우 안정화 효과가 뛰어나서 그 우열을 가리기 어려웠다.
다음으로 인간 유래의 아드레날린 수용체를 타겟으로 개발한 BTM양친매성 분자를 평가하였다. 수용체의 리간드 결합 능력을 측정하는 방법으로 수용체의 안정성을 평가하였고 초기 결과에서 M-입체이성질체가 다른 입체이성질체보다 우수하였고 그 중에서도 가장 긴 사슬을 가진 M-BTM-C11이 가장 우수한 특성을 보여주었다. 수용체의 장기간 안정성 평가에서도 M-입체이성질체를 사용했을 때 다른 이성질체나 DDM을 사용했을 때 보다 향상된 단백질 안정성을 확보할 수 있었다.
마지막으로 탄수화물 유도체 수송을 담당하는 MelB단백질의 안정성을 단백질의 열적 안정성을 측정하여 평가하였다. 낮은 온도에서는 테스트한 모든 양친매성 분자들이 이 단백질의 용해성을 잘 유지했지만 온도를 55도로 올리자 DDM에 용해되어 있는 MelB단백질의 안정성은 급감했고 3개의 BTM 분자는 모두 80% 이상의 높은 보존율을 보여주었다. 이 경우에도 M-입체이성질체가 가장 우수하였고 이 이성질체의 경우에는 온도를 65도까지 올려도 관측 가능한 효과를 보여주었다.
BTM의 3가지 입체이성질체 중 M-입체이성질체가 일관되게 우수한 세포막 단백질 안정화 특성을 보여주었는데 이는 이 입체이성질체가 막단백질 주위를 둘러쌓을 때 양친매성 분자간의 상호작용이 매우 효율적으로 이루어져 안정한 마이셀을 형성할 수 있기 때문이며 이는 이 분자의 기하학적 구조에서 그 근원을 찾을 수 있다.
3. 기대효과
이 연구의 목적은 세포막 단백질 구조 및 기능분석용 툴을 제공하는 것이다. 따라서 이 연구에서 개발된 M-BTM-C11 양친매성 분자는 현재 막단백질 연구의 gold standard인 DDM보다 월등하게 성능이 뛰어나기 때문에 다양한 단백질의 3차 구조를 원활이 규명하고 나아가 신약개발 및 생체신호전달 메카니즘을 이해하는데 초석이 될 수 있다. 또한 이 연구에서 제공한 입체화학 관련 양친매성 분자 설계 원리는 앞으로 우수한 특성을 지닌 양친매성 분자를 설계 및 개발하는데 중요한 밑거름이 될 것이다.
연구팀은 수년간의 연구를 통해 독자적으로 구축한 양친매성 분자 설계 원리를 바탕으로 우수한 특성을 띠는 양친매성 분자를 다수 개발해왔고 또한 특허 및 기술이전을 통해 많은 양친매성 분자들을 상용화한 바 있다. 현재 본 연구팀이 개발한 양친매성 화합물 15종이 미국 회사인 Anatrace에서 시판되고 있고 이중에는 올 초에 Anatrace에 기술이전한 MNA양친매성 분자 3종을 포함한다. 또 다른 2종의 양친매성 분자는 Avanti에서 시판되고 있다. 또한 최근에 개발된 NDT와 MGA 양친매성 분자들은 Avanti와의 독점계약을 통해 그 기술이전을 완료하였고 이 연구에서 개발한 BTM도 현재 Avanti와 기술이전을 추진 중에 있어 조만간 이들 분자들이 상용화되고 막단백질 연구자들이 유용하게 사용할 것이다.
연구팀은 새로운 양친매성 분자 개발 연구를 통해 올 초에 케미컬 사이언스 (IF = 9.14)와 미국화학학회지 (IF = 13.04) 에 단독 교신저자로 게재한 바 있다. 또한 연구팀이 최근 3년간 개발한 양친매성 분자들은 그 우수성과 실용성을 인정받아 해외특허(PCT) 6건의 출헌을 완료하였고 올해만도 3건의 해외 기술이전을 성사시켰다. 이 연구에서 개발한 BTM 분자들도 해외 특허 (PCT) 출원 예정이다.
★ 연구 이야기 ★
□ 연구를 시작한 계기나 배경은?
세포막단백질은 입체화학적 특성을 갖고 있는 생체고분자이다. 따라서 양친매성분자의 입체화학이 세포막 단백질과의 상호작용에 영향을 주어 단백질 안정성에 큰 변화를 줄 것이라는 가정하에 실험을 진행하였다. 또한 이에 기존에 도출한 양친매성 분자 설계 원리에 의하면 양친매성 분자간의 상호작용도 분자의 입체화학에 영향을 크게 받는 특성이 있어 막단백질에 다수의 양친매성 분자가 결합할 때 다른 효과를 줄 것이라 예상하였다.
□ 연구 전개 과정에 대한 소개
먼저 우수한 특성을 지닐 것이라 예상되는 양친매성 분자를 설계하고 이에 대한 합성 방법을 고안한 후 그 과정에 따라 타깃 양친매성 분자를 합성한다. 다양한 평가를 위해서 수백 밀리그램을 합성하며 합성된 양친매성 분자는 그 용해도를 수용액에서 측정하고 충분한 용해도를 갖는 분자들은 임계 마이셀 농도, 마이셀 크기를 측정후 각각을 타깃 세포막 단백질에 대해 평가하여 개발한 양친매성 분자의 특성을 파악한다. 필요시 추가적인 양친매성 분자를 설계하여 같은 과정을 통해 평가를 하고 기존 물질보다 우수한 특성을 지닌 새로운 양친매성 분자를 발굴한다.
□ 연구하면서 어려웠던 점이나 장애요소가 있었다면 무엇인지? 어떻게 극복(해결)하였는지?
입체화학을 갖는 분자를 합성하는 것은 그 합성 과정이 까다롭고 비용이 많이 들 수 있다. 그러나 이 연구에서는 잘 알려진 유기화학적 합성법을 활용하여 효율적으로 입체화학을 양친매성 분자에 도입할 수 있었다.
□ 이번 성과, 무엇이 다른가?
입체화학적인 특성을 갖는 양친매성 분자를 막단백질 안정성에 대해 체계적으로 평가한 예는 없다. 본 연구에서 처음으로 양친매성 분자 내에 입체화학적인 특성을 도입하고 이를 비교 평가함으로써 단백질의 안정성에 대한 양친매성 분자의 입체화학의 효과를 규명한 첫 사례라 할 수 있다.
□ 꼭 이루고 싶은 목표와 향후 연구계획은?
매우 도전적인 막단백질 및 그 복합체의 구조를 밝혀 신약 개발과 생명현상의 메카니즘 규명에 크게 이바지 하고 싶다.
□ 기타 특별한 에피소드가 있었다면?
처음에 설계, 개발한 BTM양친매성 분자를 막단백질의 안정성 측면에서 평가했을 때 결과가 좋지 않았다. 하지만 이에 포기하지 않고 새로운 BTM분자를 추가적으로 합성하여 평가한 결과 기존 양친매성 분자인 DDM 보다 우수한 BTM분자를 개발할 수 있었다.
용 어 설 명
1. 양친매성분자 (amphiphiles)
○ 물에 친한 친수성기와 물과 친하지 않는 소수성기를 동시에 갖고 있는 화합물로서 물과 기름에 모두 친한 분자임. 수용액에서 자가조립구조인 마이셀을 형성하는 특성을 지님.
2. 입체이성질체 (stereoisomer)
○ 같은 종류의 원소들이 같은 배열로 연결되어 있어 화학식은 갖지만 3차원적 배열 방향이 달라 물리적인 성질이나 광학적 성질이 다른 화합물을 일컬음.
3. 키랄중심 (chirality center)
○ 한 원소 주위에 다른 4개의 치환기가 붙어있을 때 그 중심원자를 키랄 중심이라고 하고 분자의 광학 활성을 나타내는 근원이 됨.
4. 도데실말토사이드 (dodecyl maltoside (DDM))
○ 120개 이상의 전통적인 양친매성 분자 중 현재 세포막단백질 연구에 가장 널리 사용되고 있는 화합물로 소수성기와 친수성기로 각각 도데실 사슬과 말토사이드을 지님.
5. 크기배제크로마토그래피 (size exclusion chromatograpy)
○ 여러 물질이 혼합되어 있는 혼합물을 그 크기별(분자량별)로 분류해주는 분석방법. 분자량이 작은 것은 컬럼에서 천천히 나오고 분자량이 큰 것들은 빨리 나옴.
6. G-단백질연결수용체 (G protein-coupled receptor)
○ 세포막에 존재하여 외부신호를 전달하는 수용체로 특정 호르몬과 G-단백질과 결합하여 활성화 상태가 되고 이 활성화 상태의 단백질은 그 특정 호르몬에 해당하는 신호를 세포내에 전달하여 임무를 수행함. 이 단백질은 신약의 주요 타깃이 됨.
그 림 설 명
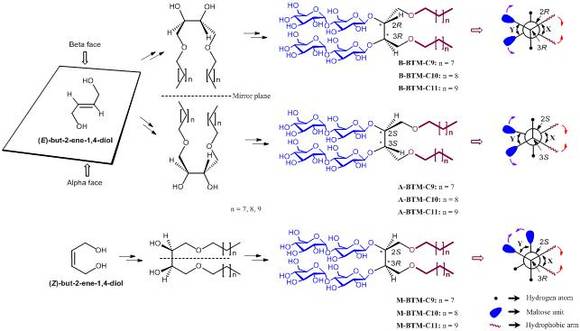
(그림 1) 새롭게 개발한 BTM 양친매성 입체이성질체의 합성 과정
양친매성 분자 합성을 위해 출발 물질로 사용한 알켄의 화학구조 (맨 왼쪽), BTM 양친매성 분자의 소수성 부분 사이의 입체화학적인 관계 (왼쪽 가운데), 막단백질 안정화 평가에 사용된 BTM 양친매성 분자의 화학구조 (오른쪽 가운데), BTM 양친매성 분자의 뉴만 투영도 (맨 오른쪽).
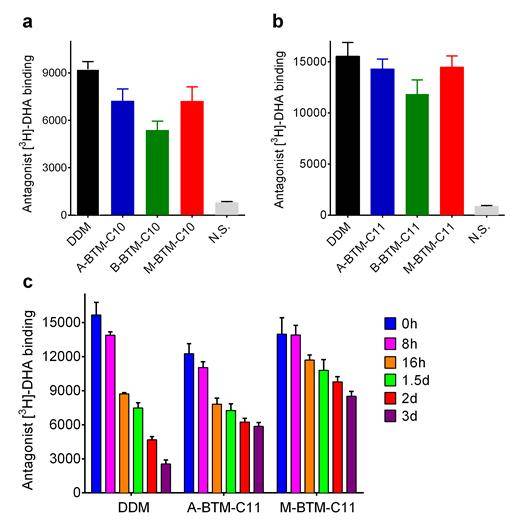
(그림 2) 아드레날린 수용체의 리간드 결합 활성을 측정
알킬 사슬 길이가 C10 그리고 C11인 BTM 양친매성 분자에 의해 용해된 수용체의 초기 리간드 결합 활성을 측정한 결과 (a,b). 이 초기 실험에서 우수한 특성을 보여준 두 개의 양친매성 분자 (A-BTM-C11과 M-BTM-C11)을 선택하여 수용체의 장기간 안정성을 상온에서 3일 동안 인규베이션 하면서 단백질 활성을 통해서 평가한 결과, C10 알킬사슬 길이보다는 C11 알킬사슬 길이를 갖는 BTM이 더 우수하였으며 그 중에서도 M-입체이성질체에 의해 용해된 수용체가 가장 안정적이었음.
