●초기 단계에서 치료 시작
시, 알츠하이머병 환자 50% 이상에서 3년 후 인지 기능 개선
●아밀로이드 베타 제거 후에도
알츠하이머병 진행, 치료 유지 중요성 확인
●에자이, “장기 효과 확인 위해 추가 연구를 통한 데이터 확보 지속할 것”
한국에자이(대표 고홍병)는 알츠하이머병
치료제 ‘레켐비(성분명 레카네맙)’의 3년 연구 결과가 7월 30일(현지시각) 미국
필라델피아에서 열린 2024 알츠하이머협회 국제학술대회(Alzheimer’s
Association International Conference, 이하 AAIC)에서
발표되었다고 밝혔다. 발표에 따르면 레켐비는 3년 간의 장기
치료 시에도 알츠하이머병으로 인한 경도인지장애 또는 경증 알츠하이머병 환자 대상 유의미한 치료 효과를 보이는 것으로 확인되었다.[i]
레켐비는 3년 치료 시 임상치매척도(Clinical
Dementia Rating Sum of Boxes, 이하 CDR-SB)가 위약군 대비 0.95점 감소된 것으로 나타나 초기 단계에서 알츠하이머병 진행 지연 효과를 보였다.1 이는 레켐비 3상 임상인 Clarity AD[1]를
완료한 환자 95%가 참여한 공개연장연구(Open-Label Extension
study, 이하 OLE) 결과로1, Clarity AD 핵심 연구에서 레켐비는 18개월 시점에 위약군 대비 CDR-SB를
0.45점(P=0.00005)을 감소시켜 알츠하이머병 진행 지연 효과를 입증한 바 있다.[ii] 또한 3년의 치료 기간
중 새로운 안전성 문제는 발생하지 않았다.1
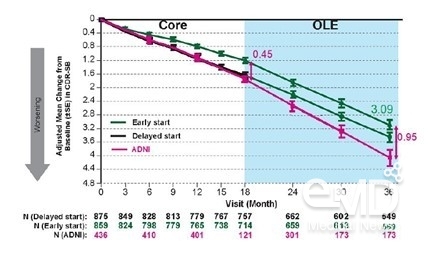
▶[그래프1] 레켐비 3상임상 Clarity
AD 및 공개연장연구(OLE)에서 36개월 간
CDR-SB 조정평균 변화1
특히 Clarity AD에 참여한 환자 중 타우(tau) 단백질 수치가 낮은 환자군에서는 레켐비 3년 치료 시 59%(41명 중 24명)가
질병이 개선되거나 유지되었으며, 51%(41명 중 21명)에서 CDR-SB 점수가 개선된 것으로 나타났다.1 2차 평가지표인 ADAS-Cog14(Alzheimer’s Disease Assessment Scale)와 ADCS MCI-ADL(Alzheimer’s Disease Cooperative Study–Activities of
Daily Living Scale for Mild Cognitive Impairment)는 각각 환자의 61%와 59%에서 개선되었다.1 타우 단백질은 아밀로이드
베타 단백질과 함께 알츠하이머병 환자의 인지 기능 저하에 영향을 미치는 요인으로[iii], 타우 단백질 수치가 낮다는 것은 보다 초기 단계의 알츠하이머병 환자임을 의미한다.1
한국에자이 고홍병 대표는 “이번 발표는 레켐비 치료를 보다 조기 단계에서
시작할 경우 장기적이고 지속적인 치료 효과를 누릴 수 있으며, 3년 이상 장기 치료에도 레켐비의 치료
효과와 안전성이 지속된다는 것을 확인했다는 점에서 의미가 있다”며, “에자이는
앞으로도 알츠하이머병에서 레켐비의 지속적이고 장기적인 효과를 입증하기 위해 추가 연구를 통해 데이터를 확보해 나갈 것”이라고 전했다.
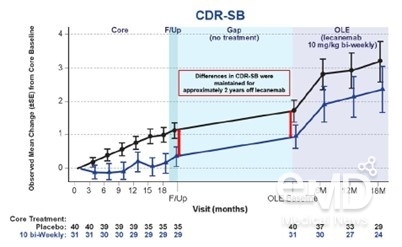
▶[그래프2] Clarity AD 공개연장연구(OLE)에서 레켐비 치료 중단
및 재개 후 CDR-SB 변화1
또한 초기 알츠하이머병 환자 856명을 대상으로 진행된 다기관, 이중 맹검, 위약 대조 레켐비
2b상 임상 시험인 Study 201에 따르면, 치료를
중단할 경우 환자의 인지저하율은 위약군의 수준이 되는 것으로 나타났다.1 Study 201에 참여한 환자가 공개연장연구(OLE)에서 치료 중단 기간 후 레켐비 치료를 재개했을 때에는 아밀로이드 베타 및 타우 단백질 수치가 다시 개선되었다.1 이를 통해 아밀로이드 베타
플라크가 제거된 뒤에도 알츠하이머병은 진행되므로, 관련 바이오마커 개선을 지속적으로 관리해야 치료 효과가
유지된다는 것이 확인됐다.1
레켐비는 뇌 내 가장 신경독성이 강한 아밀로이드 베타(Aβ) 원섬유(protofibrils) 및 올리고머(Oligomer), 응집체(aggregates)에 선택적으로 결합해 이들이 형성하는 플라크를 제거하고 아밀로이드 베타 축적을 예방하는 매커니즘을
기반으로 초기 알츠하이머병 환자의 질환 진행 및 인지 기능 저하 속도를 늦추는 효과를 인정받아 승인된 최초의 치료제다.2,[iv] 현재 한국[v]을 비롯 미국4, 일본[vi],
중국[vii],
홍콩[viii],
이스라엘[ix]에서 알츠하이머병으로 인한
경도인지장애 또는 경증 알츠하이머병 성인 환자의 치료제로 허가를 받았다.
[1] Clarity AD: 알츠하이머병으로 인한 경도인지장애 및 경증 치매 환자 1,795명을 대상으로 진행된 글로벌 3상 위약 대조, 이중 맹검, 평행 그룹, 무작위 배정 연구로(레카네맙 투여군: 10 mg/kg 격주 정맥 주입 치료 898명, 위약군: 897명), 레카네맙 투약 18개월 후 주요 1차 평가 지표인 임상치매척도(CDR-SB, Clinical Dementia Rating Sum of Boxes)의 변화를 측정하여 레카네맙의 유효성과 안전성을 확인하기 위해 설계되었다.2
[i] Eisai Co., Ltd. New Clinical Data Demonstrates
Three Years of Continuous Treatment with Dual-Acting LEQEMBI® (lecanemab-irmb)
Continues to Significantly Benefit Early Alzheimer’s Disease Patients Presented
at The Alzheimer’s Association International Conference (AAIC) 2024. Available
at: https://www.eisai.com/news/2024/news202456.html (Accessed
on Jul 31 2024). : Sperling, R., Selkoe, D., Reyderman, L., Youfang, C., Van
Dyck, C. (2024, July 28 - August 1). Does the Current Evidence Base Support
Lecanemab Continued Dosing for Early Alzheimer’s Disease? [Perspectives
Session] Alzheimer's Association International Conference, Philadelphia, PA,
United States.
[ii] Van Dyck, Christopher H., et al. "Lecanemab
in early Alzheimer’s disease." New England Journal of Medicine 388.1
(2023): 9-21.
[iii] 박선아 외, “알츠하이머병 뇌척수액 생물표지자 다기관 연구를 위한 예비연구”, Dementia
and Neurocognitive Disorders 2013; 12: 1-8
[iv] FDA. LEQEMBI® (lecanemab-irmb)
injection prescribing information. Available at <https://www.leqembi.com/-/media/Files/Leqembi/Prescribing-Information.pdf>. [Last accessed: July 2024]
[v] 식품의약품안전처, 레켐비주(레카네맙,) 허가사항. Available at: https://nedrug.mfds.go.kr/pbp/CCBBB01/getItemDetailCache?cacheSeq=202401277aupdateTs2024-05-30%2008:10:10.287593b [Last accessed: July 2024]
[vi] Eisai Co., Ltd. LEQEMBI® Intravenous
Infusion (Lecanemab) Approved for the Treatment of Alzheimer’s Disease in Japan
[Press release]. Available at: https://www.eisai.com/news/2023/news202359.html (Accessed
on Jul 31 2024).
[vii] Eisai Co., Ltd. “LEQEMBI®” (Lecanemab) for the
Treatment of Alzheimer’s Disease Launched in China. [Press release]. Available
at: https://www.eisai.com/news/2024/news2024No.24-45.html (Accessed
on Jul 31 2024).
[viii] Eisai Co., Ltd. “LEQEMBI®” (Lecanemab) Approved for
the Treatment of Alzheimer’s Disease in Hong Kong. [Press release]. Available
at: https://www.eisai.com/news/2024/news202449.html (Accessed
on Jul 31 2024).
[ix] Eisai Co., Ltd. “LEQEMBI®” (Lecanemab) Approved for
the Treatment of Alzheimer’s Disease in Israel. [Press release]. Available at: https://www.eisai.com/news/2024/news202451.html (Accessed on Jul 31 2024).
