그림: 박테리아가 회전하면서, 그것들은 유리 슬라이드의 표면으로부터 물을 펌프하는 와동을 만들어낸다.
고체 결정은 전자기 인력에 의해서 정확하게 기하학적으로 정렬된 원자들의 어레이이다. 그러나 이제 연구자들은 살아있는 박테리아로 만들어진 일종의 결정을 발견하였다. 이런 세포들은 박테리아가 그들의 편모로 생산하는 유체역학적 흡입에 의해서 같이 고정된다. 이런 2차원 박테리아 결정은 유리 슬라이드의 표면에 형성되지만, 미국의 연구진은 그와 같은 결정이 자연 세계에서 발생하는지를 아직 모른다. 이들 연구진은 수학적으로 이런 결정의 거동을 모델링하였으며 그것들이 결정화될 수 있는 3가지 특성을 확인하였다.
티오불룸 마유스(Thiovulum majus)는 직경이 5에서 20마이크로미터에 달하며, 염습지에 사는 구형 모양의 박테리아로서 물에서 추출된 산소에 생명을 유지한다. 그것들은 수백개의 편모로 덮여 있으며 이런 편모를 이용하여 다른 박테리아보다 더 빨리 헤엄쳐갈 수 있는 종이다. 세포들은 헤엄치면서 회전하고 종종 베일(veil)이라고 불리는 비정렬된 덩어리로 합쳐진다. 이를 통해서 이 박테리아들은 집단적으로 그들이 산소를 더 쉽게 얻을 수 있도록 물을 끌어올린다.
미국 뉴욕 Rockefeller 대학의 Albert Libchaber가 이끄는 연구진은 이런 박테리아의 움직임을 현미경 슬라이드 위의 물방울 안에서 연구하고자 하였다. 연구진은 세포가 슬라이드 또는 유리 커버 슬립에 부딪히면, 세포들이 튀어오르는 것이 아니고 초당 10번 정도 회전을 계속한다는 것을 발견하였다. 이때 세포들은 표면에 대해서 압력을 가하였다. 이것은 마치 앞으로 전진하지 못하는 프로펠러같은 상황이었다. 더구나 여러 세포들은 규칙적인 모양으로 결합하였다. 그 결과 2차원 육각형 구조를 형성하였으며 그 세포의 개수는 10~1000개였다. 이것은 원자 결정과 유사하였다. 이들 연구진이 살아있는 마이크로유기체가 결정을 형성한다는 것을 처음으로 관측한 것이다.
이 현상을 설명하기 위해서, 이들 연구진은 회전하는 박테리아 주위로 흐르는 물의 흐름을 계산하였다. 각 세포들은 옆면에서 물을 빨아들이는 와동을 만들어내고 빨아들인 물을 표면으로 민다. 이런 흐름으로 박테리아는 표면에 압착되고 그들끼리 서로 붙게 되어 원자 결정 안에서 원자들을 고정시키는 전자기력의 수력동역학 버전이 형성되는 것이다.
이들 연구진은 또한 결정의 회전을 모델링하였다. 이런 회전은 각 세포의 회전에 의해서 구동된다. 결정에 대한 회전력은 가장자리에서 세포에 의해서만 만들어진다. 내부 세포의 다중힘은 상쇄된다. 연구진의 방정식은 결정이 성장하면서, 가장자리에서 증가하는 회전력은 궁극적으로 임계 크기 이상으로 성장하면 붕괴되게 만든다. 이들 연구진은 아직 그런 임계 크기를 결정하지 못하였다. 더구나 이들 연구진은 매우 안정적인 육각형을 형성하는 세포의 특정한 개수를 포함하는 결정을 발견하였다. 이런 구조에서 단일 세포를 더하거나 제거하면 전체 결정은 붕괴하게 된다. 이들 연구진은 이런 흥미로운 동역학을 조사할 계획이라고 말하였다.
이들 연구진은 세포의 세 가지 특성이 결정이 다음과 같은 현상이 형성되도록 만든다는 것을 발견하였다. 첫째는 각 세포에 의해서 강력한 유체 흐름이 발생한다는 것과 둘째 더 높은 용해된 사소를 가진 영역 안에서 집단을 형성하는 경향이 있다는 것, 그리고 마지막으로 편모로 둘러싸인 구형 모양이라는 것이다. 그러나 실제 자연 상태에서 양호한 관측을 하는 것이 어렵기 때문에, 연구자들은 박테리아가 자연 상태에서 결정화되는지를 모르고 있다. 연구진은 박테리아들이 자체 조직 형태로 새로운 물질 형태를 형성하는 매우 흥미로운 특성을 보여주었다고 말하였다. 이들의 연구 결과는 Physical Review Letters 저널에 "Fast-Moving Bacteria Self-Organize into Active Two-Dimensional Crystals of Rotating Cells"라는 제목으로 발표되었다.
Focus: Bacteria Stick Together as Living Crystals
April 17, 2015• Physics 8, 35
Rotating bacterial cells suck one another into a 2D crystal structure, an unprecedented pattern for living organisms.

Figure caption
expand figure
A. Petroff et al., Phys. Rev. Lett. (2015)
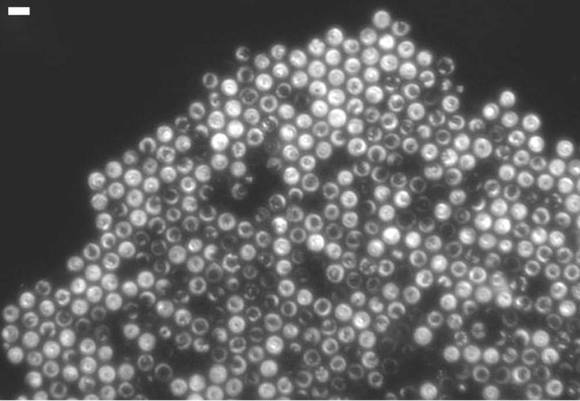
Crystalline clarity. A large crystal of spinning T. majus bacteria, showing the faceted edges and lattice vacancies typical of atomic crystals. (Scale bar at upper left is 10 micrometers.)
A solid crystal is an array of atoms held in a precise geometric arrangement by electromagnetic attraction, but now researchers have discovered a kind of crystal made of living bacteria. The cells are held together by the hydrodynamic suction the bacteria generate with their flagella. The 2D “bacterial crystals” formed on the surface of a glass slide, but the researchers don’t yet know whether such crystals form in the natural world or what function they might serve. The team mathematically modeled the behavior of the crystals and identified three characteristics of the cells that allow them to crystalize.
Thiovulum majus are large (5- to 20-micrometer-diameter), spherical bacteria that live in salt marshes and survive on oxygen extracted from the water. They are covered with hundreds of tiny flagella that allow the species to swim faster than any other bacteria. The cells rotate as they swim, and they often join together into disordered clumps called veils through which they collectively pump water in order to increase their access to oxygen [1].
Researchers led by Albert Libchaber of Rockefeller University in New York wanted to study the movement of these bacteria in a drop of water on a microscope slide. The researchers were amazed to see that, when the cells bumped into either the slide or the glass cover slip, they did not rebound. Instead, they continued to rotate roughly 10 times per second while pressing against the surface, like a propeller unable to move forward. Moreover, multiple cells became bound into regular, 2D hexagonal lattice structures of 10-1000 cells, analogous to atomic crystals, complete with lattice vacancies and faceted edges. The team decided to document and model these structures, the first examples researchers have seen of living microorganisms forming a crystal.
A small rotating crystal of T. majus bacteria. As the bacteria spin, they create a vortex that pumps water away from the surface of the glass slide, keeping the cells pressed against it.
To explain this phenomenon, the researchers calculated the water flow around the spinning bacteria. Each cell creates a vortex that sucks water in from the sides and pushes it away from the surface. This flow keeps the bacteria pressed to the surface and also draws them together, creating a hydrodynamic version of the electromagnetic attraction that binds atoms in an atomic crystal.
The team also modeled the rotation of the crystals, which is driven by the rotation of the individual cells. The rotational forces on a crystal are produced solely by the cells at the edges, as the multiple forces on interior cells cancel out. The researchers’ equations show that, as a crystal grows, the increasing rotational forces at its edges eventually cause it to “melt” (fall apart) when it grows beyond a critical size, although the team has not yet determined what that size is. In addition, the team found that crystals containing specific numbers of cells that can form very stable hexagons—such as 7, 19, and 37—are particularly stable, and adding or removing a single cell can cause an entire crystal to melt. Team member Alexander Petroff says the researchers are planning to investigate these curious dynamics, which “let crystals count how many cells they’re composed of.”
The team found that three characteristics of the cells allow the crystals to form: (1) strong fluid flow generated by each cell, (2) a propensity to congregate closely in regions with higher dissolved oxygen, and (3) spherical shape covered with flagella. However, it’s difficult to make good observations in mud, so the researchers don’t know whether the bacteria crystallize in their natural environment, or whether doing so provides any benefit, compared with disordered veils. “What we’re definitely seeing here is a bacterium that’s solving a very peculiar problem of getting nutrients fast enough,” says Petroff. The bacteria are “doing it by self-organizing into a new state of matter that has a lot of interesting properties we can’t wait to understand,” he says.
Timothy Pedley of the University of Cambridge in the UK says that work in his own lab on Volvox carteri colonies that orbit around each other arrived at the same fluid dynamical equation in 2009 [2]. He has not seen crystal formation before but was not surprised by it. However, Knut Drescher of the Max Planck Institute for Terrestrial Microbiology in Marburg, Germany, whose Ph.D. work included the 2009 research with Pedley, is more positive. He says the results represent an important new example of microswimmer collective behavior.
This research is published in Physical Review Letters
–Tim Wogan
Tim Wogan is a freelance science writer in London.
References
1.T. Fenchel and R. N. Glud, “Veil Architecture in a Sulphide-Oxidizing Bacterium Enhances Countercurrent Flux,” Nature 394, 367 (1998)
2.K. Drescher, K. C. Leptos, I. Tuval, T. Ishikawa, T. J. Pedley, and R. E. Goldstein, “Dancing Volvox: Hydrodynamic Bound States of Swimming Algae,” Phys. Rev. Lett. 102, 168101 (2009)
