암에 대한 T 세포 면역 치료 분야에서 핵심적인 도전은 작용 세포들의 분화를 촉진시키며 동시에 장기 기억에 필요한 T 세포의 자가 재생을 유도하는 것이다. 덜 분화된 기억 T 세포들의 전달은 생체 내에서 상당한 증식과 지속성을 통해 효능을 증가시키지만 면역 억제적인 종양 미세환경 내에서 작용 기능들을 유지하는 능력은 여전히 제한적이다.
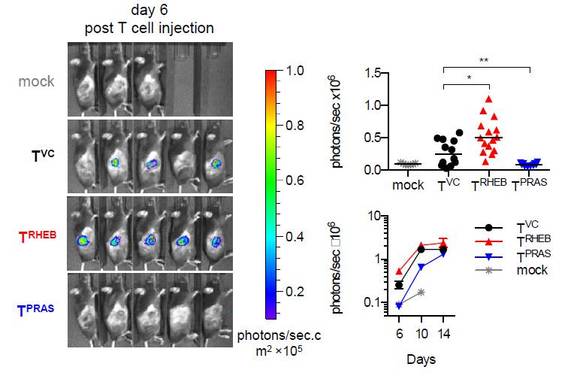
(그림 설명) EL4-NP 종양을 갖고 있는 생쥐에 Firefly luciferase+ TRHEB, TPRAS, TVC 나 mock-transduced CD8+ T 세포를 주입한 후 T 세포의 축적을 바이오 형광을 통해 측정한 결과.
영국 런던 대학 암 연구소 (Cancer Institute, University College London)의 로존 차크라버티 (Ronjon Chakraverty) 교수 연구팀은 mTOR을 통해 세포의 운명을 조절하는 분자 스위치를 도입함으로 종양을 갖고 있는 생쥐에서 치료 T 세포들의 작용 세포와 기억 분화에 대한 영향을 직접적으로 비교한 결과를 발표했다. RHEB (RAS homologue enriched in brain)의 발현은 mTORC1 (mTOR complex 1) 신호전달을 증가시키고 호기성 당분해로 인해 분화를 촉진시키며 작용 T 세포들의 증식을 증가시켰다. 신속한 종양 내로의 침투를 통해 RHEB를 발현하는 T 세포들은 면역편집으로 회피를 유도하는 암 세포들의 성장을 현저히 감소시켰다. 반대로 PRAS40 (proline-rich Akt substrate of 40kDa)의 발현은 mTORC1 를 억제하여 T 세포의 활성화를 억제하며 종양으로 침투를 했다. PRAS40 의 발현을 통해 mTORC1low T 세포들은 초기 종양 조절에 기여하지 않았지만 대신 기억 면역을 재생하는데 뛰어난 기억 세포들로 생존을 유지했다. 이번 결과는 암에 대한 다양한 T 세포 면역을 형성하는 전략을 디자인하고 작용 세포 분화와 증식 간의 적절한 균형에 대한 이해를 돕고 있다. 약물학적인 길항제들과는 달리 유전적인 접근법은 mTORC1 경로의 상승과 억제를 통해 전신에 걸친 mTORC1 기능들에 영향을 주지 않고 치료 T 세포들에 대해서만 매우 선택적인 조절을 가능하게 하고 있다.
T 세포 면역 치료 분야에서 핵심적인 도전은 장기간에 걸쳐 면역 감시에 요구되는 T 세포 기억의 발달을 손상시키지 않고 암 세포들을 제거하는 강력한 작용 반응들을 유도하는 적절한 전략을 개발하는 것이다. 면역 반응들에 관한 최근 연구 결과들은 각각의 naïve CD8+ T 세포들과 항원의 노출에 따르는 다양한 세포들의 반응들이다. 초기 클로날 확장은 몇 번의 증식을 거쳐 단기간 생존하는 작용 세포들로 주로 구성되지만 초기 반응 과정에서 낮게 증식하는 세포들은 기억의 잠재성과 함께 2, 3차 항원의 노출에 대한 기억 반응에 기여한다. 기억 세포들은 초기 항원의 노출에 의해 최소한으로 자극되고 항원의 재 노출 시 자가 재생을 통해 작용 세포들과 기억 세포들로 매우 효과적으로 분화된다.
입양 전달을 통한 면역 치료 조건에서 T 세포 분화와 종양 면역의 반비례 관계가 기술된 바 있다. 즉, 완전히 분화된 마지막 단계에 있는 작용 세포들의 입양전달은 덜 분화된 T 세포들의 전달 보다 덜 효과적이다. 완전히 분화된 작용 세포들의 비 효율성은 생체 내에서 빈약한 증식 및 생존과 연관되어 있고 덜 분화된 기억 줄기 세포들은 팽창하고 장기간 생존한다. 이러한 관찰은 생체 내에서 증식하고 유지하는 잠재성을 갖고 있는 세포들을 전달하는 것이 중요하다는 점을 강조하지만 종양을 갖고 있는 숙주에서 작용 기능들을 유지하는 이러한 세포들의 능력은 매우 제한적이다. 실제로 종양 미세환경은 작용 분화를 억제함으로 T 세포 치료의 효능을 제한한다. 따라서 기억 잠재성을 향상시키기 위한 치료 전략은 작용 기능들에 대한 영향을 고려하여 평가되어야 한다.
본 논문에서 연구팀은 mTORC1 경로를 각각 양성적이고 음성적으로 조절하는 핵심 분자들인 RHEB와 PRAS40의 과다 발현을 통해 암에 대한 입양 면역 치료법의 생쥐 모델에서 작용세포의 기능과 기억의 상대적인 역할을 조사했다. 이번 결과는 종양에 특정한 T 세포들에서 RHEB의 과다 발현이 mTORC1 활동을 증가시키고 초기 종양 침투를 촉진시키며 면역 회피로 인한 암의 진행을 막는 현상을 보고하고 있다. 반대로 PRAS40의 일시적인 과다발현은 mTORC1 의 활동을 감소시키고 이어지는 기억 면역을 증가시켰다. 종합해 볼때 이러한 결과들은 RHEB와 PRAS40이 매개하는 mTORC1 의 조절이 생체 내에서 종양에 특정한 T 세포들의 작용 기능과 기억 분화를 향상시키는데 사용될 수 있음을 암시하고 있다.
Genetic regulation of fate decisions in therapeutic T cells to enhance tumor protection and memory formation
Pedro Velica1, Mathias Zech1, Sian Henson2, Angelika Holler1, Teresa Manzo1, Rebecca Pike1, Pedro Santos e Sousa1, Lei Zhang3, Bernhard Schledlmeier4, Martin Pule5, Hans Stauss6, and Ronjon Chakraverty1,*
+ Author Affiliations
1Haematology Department, Cancer Institute, UCL
2Div of Infection & Immunity, UCL
3College of Life Science, Liaoning Normal University
4Experimental Haematology, Hannover Medical School
5Department of Haematology, Cancer Institute, UCL
6University College Londo
↵* Corresponding Author:
Ronjon Chakraverty, Haematology Department, Cancer Institute, UCL, Rowland Hill Street, London, NW3 2PF, United Kingdom r.chakraverty@ucl.ac.uk
Abstract
A key challenge in the field of T cell immunotherapy for cancer is creating a suitable platform for promoting differentiation of effector cells while at the same time enabling self-renewal needed for long-term memory. Although transfer of less differentiated memory T cells increases efficacy through greater expansion and persistence in vivo, the capacity of such cells to sustain effector functions within immunosuppressive tumor microenvironments may still be limiting. We have therefore directly compared the impact of effector versus memory differentiation of therapeutic T cells in tumor-bearing mice by introducing molecular switches that regulate cell fate decisions via mTOR. Ectopic expression of RAS homologue enriched in brain (RHEB) increased mTOR complex 1 (mTORC1) signaling, promoted a switch to aerobic glycolysis and increased expansion of effector T cells. By rapidly infiltrating tumors, RHEB-transduced T cells significantly reduced the emergence of immunoedited escape variants. In contrast, expression of proline-rich Akt substrate of 40kDa (PRAS40) inhibited mTORC1, promoted quiescence and blocked tumor infiltration. Fate mapping studies following transient expression of PRAS40 demonstrated that mTORC1low T cells made no contribution to initial tumor control but instead survived to become memory cells proficient in generating recall immunity. Our data support the design of translational strategies for generating heterogeneous T cell immunity against cancer, with the appropriate balance between promoting effector differentiation and self-renewal. Unlike pharmacological inhibitors, the genetic approach described here allows for up-regulation as well as inhibition of the mTORC1 pathway, and is highly selective for the therapeutic T cells without affecting systemic mTORC1 functions.
Received November 10, 2014.
Revision received March 16, 2015.
Accepted March 26, 2015.
Copyright © 2015, American Association for Cancer Research.
