
방사성 요오드에 불응한 국소 재발성 또는 전이성의 진행성 분화 갑상선암에 효과적인 치료 옵션 제시할 것

한국에자이(대표 고홍병)는 11일 서울 플라자호텔에서 렌비마® 출시 기자간담회를 개최하고 방사성 요오드에 불응한 국소 재발성 또는 전이성의 진행성 분화 갑상선암 치료제 ‘렌비마®캡슐(성분명: 렌바티닙메실산염, 이하 렌비마®)’의 3상 임상 결과를 발표했다.
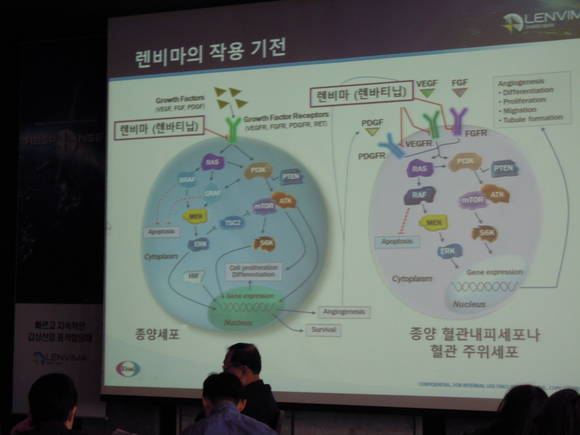
렌비마®는 글로벌 제약사 에자이의 츠쿠바 연구소에서 자체적으로 개발한 경구용 표적 항암제로, 혈관내피세포증식인자수용체(VEGFR) 1-3 및 섬유아세포증식인자수용체(FGFR) 1-4, 혈소판유래성장인자수용체(PDGFR-α), RET유전자, KIT 유전자를 동시에 억제하는 다중 키나아제 억제제다.

특히, 렌비마®는 기존 표적항암제와 달리 섬유아세포증식인자수용체(FGFR)를 함께 억제해 보다 강력한 효과를 가지는 새로운 ‘Type V 키나아제 저해제’로 분자와 빠르게 결합하고, 오랜 기간 작용한다.
한국에자이 고홍병 대표는 “지금까지는 방사성 요오드에 불응한 분화 갑상선암에 효과적인 기준 치료법이 정립되지 않아 어려움을 겪는 환자들이 있었다”며, “무진행생존기간의 유의미한 연장과 높은 반응률이 입증된 렌비마®의 출시로 방사성 요오드 치료에 불응한 갑상선암 환자들도 효과적으로 갑상선암을 치료받을 수 있기를 희망한다”고 밝혔다.

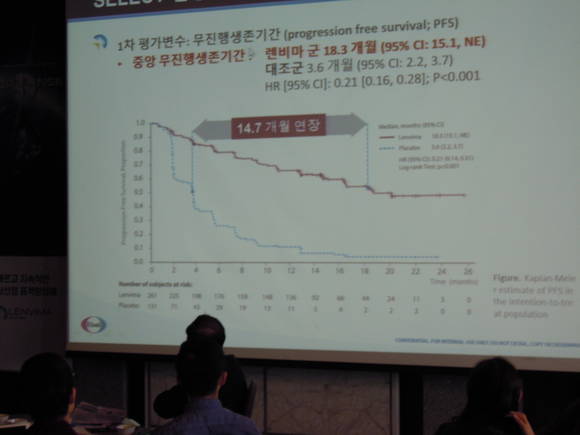
방사성 요오드에 불응한 국소 재발성 또는 전이성의 갑상선암 환자 392명을 대상으로 진행된 렌비마®의 무작위 3상 임상인 ‘SELECT’ 임상에 따르면, 렌비마® 24mg투여군의 무진행생존기간(Progression free survival)의 중간값은 18.3개월로 위약 투여군(3.6개월)에 비해 통계적으로 유의하게 생존기간을 연장시킨 것으로 나타났다.(HR [95% CI]: 0.21 [0.16, 0.28]; P<0.001)

또, 렌비마® 복용 환자군의 반응률은(ORR) 64.8%로, 위약군(2.0%) 대비 우수한 반응률을 보였으며, 2%의 렌비마® 투약 환자에게서 완전 관해, 63%에게서 부분 관해가 나타나 방사성 요오드에 불응한 분화 갑상선암에서의 렌비마®의 효과가 입증됐다. 뿐만 아니라 렌비마® 투약 환자군은 2개월(중간값, 95% CI, 1.9-3.5)만에 최초 반응을 보인 것으로 나타나 렌비마®의 신속한 작용이 확인됐다.
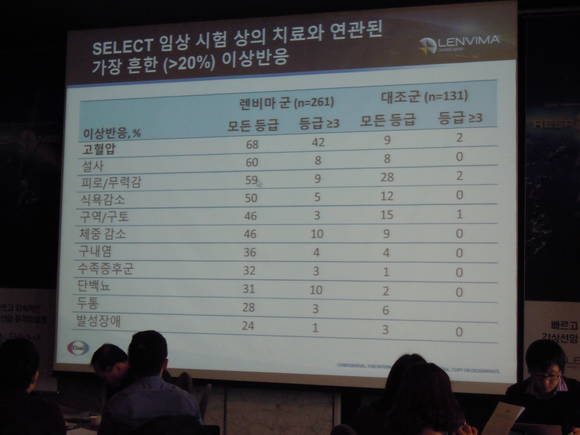
한편 임상시험에서 가장 빈번하게 나타난 이상반응은 고혈압, 설사, 피로, 무기력증, 식욕 감퇴, 체중 감소, 구토 등이었다.

서울대병원 정준기 교수는 “갑상선암 수술 후 방사성요오드 치료를 하게 되는데 이 때 방사성 요오드에 반응하지 않는 환자들이 있고, 이 경우 사실상 치료가 매우 어려웠다”며, “새로운 치료제로 환자들이 희망을 가질 수 있게 돼 의사 입장에서 매우 반가운 일이다”라고 설명했다.

국립암센터 이은경 박사는 “2015 NCCN 가이드라인(ver2)에서도 렌비마®의 높은 반응률을 근거로 방사성 요오드에 불응한 전이성 분화 갑상선암 치료에 있어 검증된 치료제로 권고하고 있다”라며, “특히, 65세 이상의 뼈전이를 동반한 환자들에서 타 약제에 비해 좋은 효과를 기대할 수 있다”고 밝혔다.
갑상선암은 국내에서 발생률이 가장 높은 암으로, 2013년 갑상선암 발생자수는 42,541명으로 남녀 전체에서 가장 많이 발생하는 암으로 보고되고 있다. 갑상선암은 위암, 대장암, 폐암, 간암 등 다른 암과 비교해 상대적으로 예후가 좋아 높은 생존율을 가지고 있으나, 병기가 높아질수록 생존율이 낮아져, 갑상선 유두암 4기의 경우 생존율이 50%까지 떨어진다.
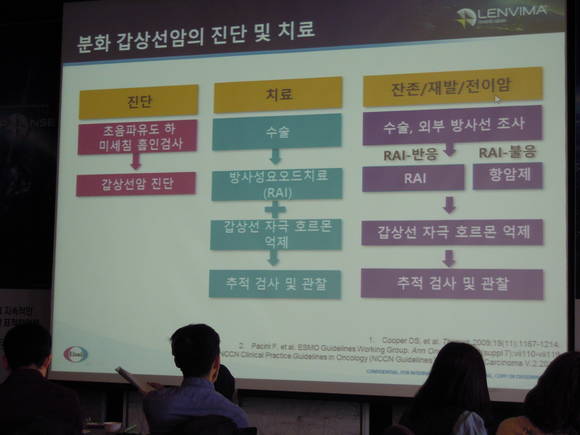
일반적으로 갑상선암은 수술이 일차적인 치료법이나, 크기가 작고 접근이 어려운 경우에는 고용량의 방사성요오드 치료를 시행한다. 하지만 방사성 요오드 치료에 반응하지 않는 경우도 있으며, 이 경우에는 표적치료제를 이용한 항암치료를 시행할 수 있다.
이번 렌비마® 출시를 통해 에자이는 한국의 갑상선암 환자들을 대상으로 새로운 치료법을 제공함은 물론 다른 아시아 국가로도 시판 승인을 확대하기 위해 노력한다는 방침이다. 한편, 렌비마®는 국내에서는 2015년 10월에 식품의약품안전처로부터 방사성 요오드에 불응한 국소 재발성 또는 전이성의 진행성 분화 갑상선암 치료제로 승인받았으며, 미국, 유럽, 일본에서도 시판중이다.
더불어 에자이는 렌비마®에 대한 간세포암 3상 임상시험을 비롯해, 신장암, 비소세포 폐암 등 다른 암종에 대해서도 임상시험을 진행하고 있다.
렌비마®에 대하여
렌비마®는 경구용표적항암제로, 혈관내피세포증식인자수용체(VEGFR) 1-3 및 섬유아세포증식인자수용체(FGFR) 1-4, 혈소판유래성장인자수용체(PDGFR-α), RET유전자, KIT 유전자를 동시에 억제하는 다중키나아제억제제다.
특히, 렌비마®는 기존 표적항암제와 달리 섬유아세포증식인자수용체(FGFR)를 함께 억제해 보다 강력한 효과를 가진다. 또, 렌비마®는 새로운 ‘Type V 키나아제억제제’로, ‘TypeⅠ,Ⅱ키나아제억제제’인 기존 표적항암제들과 차별화되는 기전을 가져 분자와 빠르게 결합하고, 오랜 기간 작용한다.
현재 에자이는 미국, 일본, 유럽, 한국, 캐나다에서 방사성요오드불응성갑상선암 치료용으로 렌바티닙에 대한 허가를 받았으며 아시아, 러시아, 호주, 브라질, 멕시코 등에서 규제적 검토를 받고있는 중이다.
한편, 에자이는 간세포암에 대한 렌바티닙의 글로벌임상 3상시험 및 자궁내막암, 담도암 등 기타 다수 종양에 대한 렌바티닙 임상 3상시험을 진행중에 있다.
한국에자이에 대하여


한국에자이는 1941년 도쿄에 설립된 글로벌 제약사 에자이(Eisai Co., Ltd.)의 한국법인으로 1997년 국내진출 이후 우수전문의약품을 소개하며 시장을 선도하고 있다.
한국에자이는 현재 국내에 아리셉트(치매증상치료제), 파이콤파, 엑세그란(항전간제) 등의 CNS 품목과 휴미라(류마티스관절염치료제), 심벤다(혈액암치료제) 등의 의약품을 직접 공급하고 있다. 한국에자이는 환자와 그 가족을 최우선으로 여기는 human health care 라는 기치아래 보다 나은 의약품 공급을 위해 최선을 다하고 있다.
References
1 국가암정보센터, 통계로 보는 암, 발생률, 암종별 발생현황http://www.cancer.go.kr/mbs/cancer/subview.jsp?id=cancer_040102000000
2 American Cancer Society_Thyroid Cancer 2014
3 이규언 등, 종양학, 갑상샘암
