높은 내성 장벽, 우월한 바이러스 억제 효능, 적은 부작용으로 치료 중단율 낮춰1,2,3,4,5
GSK(한국법인 사장 홍유석)는 새로운 인테그라제 억제제(INSTI) 계열 HIV 치료제 ‘티비케이(성분명: 돌루테그라비르 소듐)’를 4월 1일부터 국내 급여 출시한다고 밝혔다. 티비케이 50mg 1정 당 보험급여상한가는 18,762원이다.
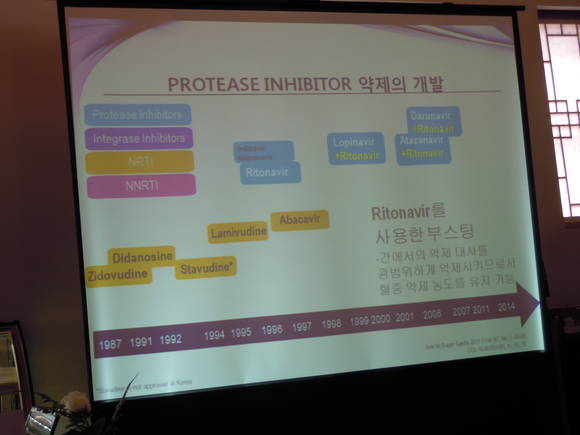
HIV 전문 제약사인 비브 헬스케어(ViiV Healthcare)가 개발한 티비케이는 현재까지 초치료 환자 대상 임상연구에서 단 1건의 내성 발현도 없었을 만큼1,3,5 내성 장벽이 높은 최초의 2세대 인테그라제 억제제다. 인테그라제 억제제는 HIV 바이러스가 복제주기 동안 사용하는 통합효소(인테그라제)를 억제해 바이러스성 DNA가 인간 면역 세포의 유전 물질로 통합되는 것을 차단함으로써 HIV의 복제를 막는다.
티비케이는 뛰어난 내성 장벽으로 치료제를 장기 복용해야 하는 HIV 감염인들이 초기부터 안심하고 사용할 수 있는 것이 가장 큰 장점이다.1,3,4,5 복약 편의성도 높아 50mg 알약 한 정을 식사와 관계없이 하루 한번 아무 때나 편하게 복용하면 되며, 인테그라제 억제제 계열에 내성이 없는 경증, 중등증 또는 중증의 신장애 환자에게도 용량 조절이 필요 없다.6 부작용을 줄여 치료 중단율도 획기적으로 낮췄다.2,3,4,5
바이러스 억제 효능 또한 뛰어나다. 티비케이는 초치료 환자에서 48주째에 에파비렌즈 대비 우월한 효능을 증명한 최초의 약제로,1 다양한 임상연구를 통해 효능의 우월성 및 비열등성을 입증했다. 초치료 환자에서 다루나비르/리토나비르 대비 우월한 효능을 보였으며, 랄테그라비르에 대해서는 INSTI 계열 치료 경험이 없는 치료 변경 환자를 대상으로 한 연구에서 우월성을, 초치료 환자에서 비열등성을 입증했다.3,4,5

GSK 홍유석 사장은 “최근 세계적인 HIV 가이드라인들이 초치료 환자의 치료에 돌루테그라비르를 비롯한 인테그라제 억제제 기반 요법을 우선적으로 사용하도록 업데이트된7,8 때에 발맞추어 국내에서 티비케이를 급여 출시하게 되어 매우 기쁘다”며 “트리멕에 이어 티비케이를 출시함으로써 국내 HIV 감염인들에게 돌루테그라비르에 기반한 항레트로바이러스 치료 옵션의 폭을 더 넓힐 수 있게 되었다”고 말했다.

HIV 치료에 다양한 옵션이 필요한 이유는 바로 특정 약제에 대한 내성 때문이다. 1990년대 중반 이후 HIV 치료에 항레트로바이러스제 병합요법이 사용되기 시작하면서 HIV 감염인의 생존기간이 크게 연장될 수 있었으나, 최근 지속적인 항레트로바이러스제 사용으로 인해 기존 약제에 대한 내성 문제가 제기되고 있다. 질병관리본부 국립보건연구원에서 1999년부터 2014년까지 전체 신규 감염인의 약 16%인 1,309명의 미치료 HIV/AIDS 감염인을 대상으로 내성 유전자 특성을 분석한 결과, 83명(6.3%)이 적어도 한 가지 이상의 약제 계열에 대한 내성이 있을 것으로 예측되었다. 9

GSK 의학개발부 이일섭 부사장은 “HIV 바이러스는 발현된 내성 정보를 숙주 DNA에 통합하기 때문에 한 번 내성이 발현된 감염인은 평생 그 내성을 가지고 치료를 받아야 한다”며 “이렇게 획득된 약제 내성은 약제 선택의 폭을 좁히고 치료 요법을 더 복잡하게 만들 수 있는만큼 초치료부터 티비케이와 같이 높은 내성장벽 및 우수한 내약성과 편의성을 가진 약제로 시작하여 내성 발현을 예방하는 것이 중요하다”고 말했다.
[티비케이 주요 임상연구]
SINGLE 연구 소개1,2
SINGLE은 항레트로바이러스 치료 경험이 없는 833명의 HIV-1 감염 환자들을 대상으로 하루 한 번 복용하는 티비케이 50mg/아바카비르 600mg/라미부딘 300mg 대 하루 한 알 복용하는 에파비렌즈 600mg/테노포비르 300mg/엠트리시타빈 200mg 복합제*를 96주간 비교 평가한 3상 무작위, 이중맹검, 이중위약, 다국가, 다기관, 병행설계 연구이다. 48주, 96주, 144주째에 평가가 진행되었으며, 장기적인 효과와 안전성 데이터를 보기 위해 96주부터 144주까지는 공개 시험(open-label)으로 진행되었다.
48주째에 티비케이/아바카비르/라미부딘 그룹의 88%, 에파비렌즈/테노포비르/엠트리시타빈 투여 그룹의 81%가 바이러스학적 억제(HIV-1 RNA<50 copies/mL)를 달성하여 통계적으로 티비케이 그룹이 우월한 것으로 나타났으며(P=0.003), 티비케이 그룹이 바이러스학적 억제에 도달하는 데 걸린 평균 시간은 28일로 에파비렌즈 그룹의 84일에 비해 더 짧았다(P<0.001). 이후 두 그룹의 바이러스 억제율은 96주째에 각각 80% vs. 72%(P=0.006), 144주째에 71% vs. 63%(P=0.01)로 유지되어, 티비케이 그룹이 에파비렌즈/테노포비르/엠트리시타빈 투여 그룹에 비해 계속해서 우월한 바이러스 억제율을 보인 것으로 나타났다.
144주째에 이상반응으로 인한 치료 중단율은 티비케이 그룹이 4%, 에파비렌즈 그룹이 14%였다. 이 중 ≥2% 빈도로 나타난 이상반응은 에파비렌즈 그룹에서 정신질환(6%), 신경계 질환(4%), 전신 및 투여부위 질환(3%), 피부 및 피하조직 질환(2%), 위장관 장애(2%) 등이었다. 반면 티비케이 그룹에서는 정신질환(<1%), 신경계 질환(<1%), 피부 및 피하조직 질환(<1%) 외에 전신 및 투여부위 질환과 위장관 장애는 나타나지 않았다.
SINGLE 연구 144주 결과, 티비케이 그룹에서 돌루테그라비르나 아바카비르, 라미부딘 약제에 대한 내성은 발생하지 않았다.
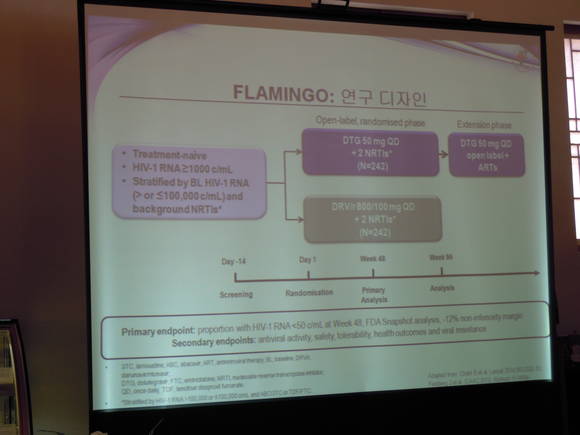
FLAMINGO 연구 소개3,10
FLAMINGO는 항레트로바이러스 치료 경험이 없는 484명의 HIV-1 감염 환자들을 대상으로 하루 한 번 복용하는 티비케이(50mg) 대 하루 한 번 복용하는 다루나비르(800mg)/리토나비르(100mg)를 각각 시험자가 선정한 NRTI 제제(테노포비르/엠트리시타빈 또는 아바카비르/라미부딘)와 병용하여 96주간 비교 평가한 3b상 다기관, 무작위, 개방표지, 활성대조군, 병행설계, 비열등성 연구다.
48주째에 티비케이 투여 그룹의 90%, 다루나비르/리토나비르 투여 그룹의 83%가 바이러스학적 억제(HIV-1 RNA <50 copies/mL)를 달성하여 12%의 비열등성 기준을 충족하였으며, 통계적으로 티비케이가 다루나비르/리토나비르보다 우월한 것으로 나타났다(P=0.025). 이후 두 그룹의 바이러스 억제율은 96주째에 각각 80% vs. 68%(P=0.002)로 유지되어, 티비케이 그룹이 다루나비르/리토나비르 그룹에 비해 계속해서 우월한 바이러스 억제율을 보인 것으로 나타났다. 또한 96주째에 티비케이 그룹과 다루나비르/리토나비르 그룹을 비교했을 때 이상반응으로 인한 치료 중단율은 3% vs 6%로, 가장 흔하게 발생한 이상반응은 설사(티비케이 10% vs 다루나비르/리토나비르 24%), 메스꺼움(13% vs 14%), 두통(7% vs 5%)이었다. 96주째에 2등급 또는 그 이상의 공복 시 LDL 실험실 검사수치 이상 발생률은 티비케이 그룹에서 다루나비르/리토나비르 그룹보다 훨씬 적게 나타났다(7% vs 22%, P=0.0001).
FLAMINGO 연구 96주 결과, 두 그룹 모두에서 치료로 인한 바이러스 변이에 따른 내성은 발생하지 않았다.
SAILING 연구 소개4
SAILING은 항레트로바이러스 치료 경험이 있지만 인테그라제 억제제로는 치료해 본 경험이 없는 719명의 HIV-1 감염 환자를 대상으로 하루 한 번 복용하는 티비케이(50mg) 대 하루 두 번 복용하는 랄테그라비르(400mg)를 시험자가 선정한 기저 요법 (background therapy) 약제와 병용하여 48주간 비교 평가한 3상 무작위, 이중맹검, 활성대조군, 이중위약, 다기관, 병행설계, 비열등성 연구이다. 48주째에 티비케이 투여 그룹의 71%, 랄테그라비르 투여 그룹의 64%가 바이러스학적 억제(HIV-1 RNA <50 c/mL)를 달성하여 12%의 비열등성 기준을 충족하였으며, 통계적으로 티비케이가 랄테그라비르보다 우월한 것으로 나타났다(P=0.03). 또한 48주째에 이상반응으로 인한 치료 중단율은 티비케이 그룹이 3%, 랄테그라비르 그룹이 4%로, 가장 흔하게 발생한 이상반응은 설사(20% vs 18%), 상기도 감염(11% vs 8%), 두통(9% vs 9%)이었다.
SAILING 연구 48주 결과, 치료로 인한 유전자형 또는 표현형 인테그라제 억제제 내성은 티비케이 그룹에서 랄테그라비르 그룹에 비해 통계적으로 더 적게 나타났다(1% vs 5%, P=0.003). 치료로 인한 기저 요법에 대한 내성은 티비케이 그룹에서 1%, 랄테그라비르 그룹에서 3%로 나타났다.
[티비케이 소개]
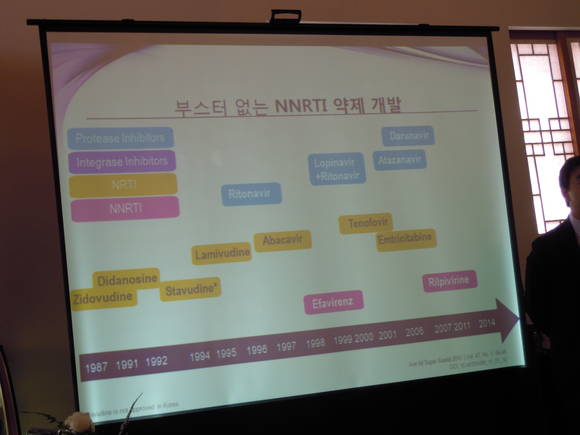
티비케이는 비브 헬스케어(ViiV Healthcare)의 첫 번째 신약으로, 하루 한 알 복용하는 인테그라제 억제제 중 부스터 없이 다른 항레트로바이러스 제제와 병용하는 최초의 약제다. 인테그라제 억제제는 HIV 바이러스가 복제주기 동안 사용하는 통합효소(인테그라제)를 억제해, 바이러스성 DNA가 인간 면역 세포(T-cells)의 유전 물질로 통합되는 것을 차단함으로써 HIV의 복제를 막는다. 이 단계는 HIV의 복제 주기에서 필수적이다.
티비케이는 2013년 8월 미국 FDA에 이어 2013년 10월 캐나다, 2014년 1월 유럽 연합에서 40kg 이상의 12세 이상 청소년 및 성인에서 HIV 감염 치료제로 승인 받았으며, 전 세계적으로 허가 신청이 진행되고 있다. 국내에서는 지난 2014년 8월 29일 식품의약품안전처로부터 ‘HIV에 감염된 성인 및 12세 이상 청소년의 치료를 위하여 다른 항레트로바이러스 의약품과 함께 사용하는 인테그라제 억제제'로 허가 받았다.
[회사 소개]

GSK (GlaxoSmithKline)- 세계적인 연구개발 중심의 헬스케어 회사로서, 인류가 건강장수와 행복을 추구하며 왕성하게 활동할 수 있도록 인간의 삶의 질을 향상시키는 일에 헌신하고 있다. 회사에 관한 자세한 정보는 www.gsk-korea.co.kr에서 확인할 수 있다.
비브 헬스케어(ViiV Healthcare)- 글로벌 HIV 전문 회사로 2009년 11월 GSK와 화이자가 HIV 치료의 발전과 환자의 케어를 위해 설립하였다. 시오노기는 2012년 10월 합류하였다. 비브 헬스케어는 HIV/AIDS에 대해 지금까지 그 어떤 회사가 수행한 것보다 훨씬 더 깊고 폭넓은 관심을 가지고 효과적인 HIV 신약 전달을 위한 새로운 접근을 시도하고 있으며, HIV 관련 커뮤니티에 대한 지원도 하고 있다. 비브 헬스케어에 대한 자세한 내용은 www.viivhealthcare.com에서 확인할 수 있다.
References
1Walmsley S, Baumgarten A et al. Dolutegravir Plus Abacavir/Lamivudine for the Treatment of HIV-1 Infection in Antiretroviral Therapy–Naive Patients: Week 96 and Week 144 Results from the SINGLE Randomized Clinical Trial. J Acquir Immune Defic Syndr.2015;70(5):515–519
2Pappa K, Baumgarten A, et al. Dolutegravir (DTG) + Abacavir/Lamivudine Once Daily Superior to Tenofovir/Emtricitabine/Efavirenz in Treatment Naive HIV Subjects: 144-Week Results from SINGLE (ING114467). ICAAC 2014; Abstract H-647a
3Molina JM, Clotet B, et al. Once-daily dolutegravir versus darunavir plus ritonavir for treatment-naive adults with HIV-1 infection (FLAMINGO): 96 week results from a randomised, open-label, phase 3b study. Lancet HIV. 2015;2:e127–136
4Cahn P, Pozniak AL, et al. Dolutegravir versus raltegravir in antiretroviral-experienced,integrase-inhibitor-naive adults with HIV: week 48 results from the randomised, double-blind, non-inferiority SAILING study. Lancet. 2013;382:700–708
5 Raffi F, Jaeger H, et al. Once-daily dolutegravir versus twice-daily raltegravir in antiretroviral-naive adults with HIV-1 infection (SPRING-2 study): 96 week results from a randomised, double-blind, non-inferiority trial. Lancet Infect Dis. 2013;13:927–935
6 GSK. 티비케이 신약신청 자료집.
7WHO. Fact Sheet: HIV Treatment and Care - What's New in HIV Treatment [Online]. 2015. Available from: http://www.who.int/hiv/pub/arv/arv2015-treatment-factsheet/en/[LastaccessedMarch2016]
8DHHS. Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents [Online]. Available from:http://www.aidsinfo.nih.gov/ContentFiles/AdultandAdolescentGL.pdf[LastaccessedMarch2016]
9질병관리본부. 미치료 HIV/AIDS 감염인의 항레트로바이러스제 내성주 변이 양상. 주간 건강과 질병. 2015;8(27):622-624
10Clotet B, Feinberg J, et al. Once-daily dolutegravir versus darunavir plus ritonavir in antiretroviral-naive adults with HIV-1 infection (FLAMINGO): 48 week results from the randomised open-label phase 3b study. Lancet. 2014;383:2222-2231
*에파비렌즈/테노포비르/엠트리시타빈 복합제는 국내에서 허가 받지 않았습니다.
