
EGFR TKI 치료 경험이 있는 EGFR T790M 변이 양성 비소세포폐암 환자들을 대상으로 타그리소와 백금기반 화학요법의 효과를 평가한 AURA3 3상 임상시험 결과 발표
연구 결과, 타그리소는 표준치료법인 백금기반 화학요법 대비 우수한 무진행생존기간(PFS) 연장 및 이전 연구와 일관된 안전성 프로파일 나타내
EGFR T790M변이 양성 비소세포폐암 치료제로서 타그리소의 유용성을 확인한 최초의 무작위 임상시험으로, 이전 연구와 일관된 결과를 통해 타그리소 허가의 근거 강화
아스트라제네카는 타그리소(성분명: 오시머티닙)가 표준치료법과의 효과를 비교한 AURA3 3상 임상시험에서 1차 유효성 평가기준(primary endpoint)을 충족시켰다고 밝혔다.
연구 결과, 타그리소는 현재 EGFR T790M 변이 양성 비소세포폐암의 표준치료법인 백금기반 화학요법(platinum-based doublet chemotherapy) 대비 우수한 무진행생존기간(Progression Free Survival, PFS)을 나타냈으며, 이를 통해 EGFR T790M 변이 양성 비소세포폐암 치료제로서의 임상적 유용성을 보였다.
AURA3 3상 임상은 상피세포 성장인자 수용체 티로신 키나제 저해제(EGFR-TKI)로 1차 치료 후 질환이 진행된 EGFR T790M변이 양성 국소 진행성 또는 전이성 비소세포폐암 환자 약 400명을 대상으로 타그리소의 2차 치료 효과와 안전성을 평가한 무작위 임상시험이다. PFS 개선과 함께 안전성 측면에서도 타그리소는 이전 연구들과 일관된 프로파일을 보였다.
또한, 타그리소는 이번 연구에서 PFS 뿐만 아니라 객관적 반응률(Objective Response Rate) 및 질환조절률(Disease Control Rate)에서도 표준치료법인 백금기반 화학요법에 비해 유의미한 개선을 보였다. 전체생존기간(Overall Survival)을 포함한 AURA3 임상시험의 전체 평가는 현재까지도 계속해서 진행되고 있으며, 최종 결과는 향후 개최될 학술회의에서 발표될 예정이다.
아스트라제네카 글로벌 신약개발부 최고 의학책임자 션 보헨(Sean Bohen) 부사장은, “이번 AURA3 연구 결과는 타그리소가 EGFR T790M 변이 양성 비소세포폐암 환자를 위한 의미 있는 치료 대안임을 보여주었을 뿐만 아니라, 타그리소의 신속한 개발을 가능케 한 아스트라제네카의 과학주도적 접근 방식 또한 유효함을 확인해주었다. 앞으로도 지속적인 연구를 통해, 더 많은 환자들의 치료와 요구를 충족시킬 수 있도록 타그리소의 잠재적 효과와 가능성을 확인해갈 것이다”고 밝혔다.
타그리소는 가장 신속하게 개발된 신약 중 하나로, 첫 임상시험부터 승인 획득까지 약 2년 반이 소요되었다. 타그리소는 미국과 유럽을 비롯해 일본, 캐나다, 스위스, 이스라엘, 멕시코에서 EGFR T790M 변이 양성 비소세포폐암 치료제로 승인되었으며, 지난 5월 국내에서도 식품의약품안전처의 시판 허가를 획득했다.
아스트라제네카는 EGFR 변이 양성 국소 진행성 또는 전이성 비소세포폐암의 1차 및 보조치료, 암세포의 뇌전이 유무, 연수막질환의 동반 유무 등과 같은 다양한 프로파일의 폐암 환자에서 타그리소의 최대 잠재력을 알아보기 위한 노력을 이어가고 있으며, 연수막 질환(leptomeningeal disease) 환자에서 나타난 타그리소의 고무적인 효과에 대해서도 발표한 바 있다.
> 비소세포성폐암이란
폐암은 전체 암 사망 원인 중 1/3을 차지하며, 성별에 관계없이 사망 원인 중 큰 비중을 차지하는 질환이다. 이는 유방암, 전립선암, 대장암 환자 수를 모두 합친 것 보다 많은 수치다. EGFR 변이 양성 비소세포성폐암은 유럽의 경우, 전체 비소세포성폐암 환자 중 10-15%, 아시아의 경우 30~40%에 달한다. 이들 환자는 특히 최근에 사용되고 있는 종양 세포의 성장을 유도하는 경로에 신호를 보내는 세포를 차단하는 역할의 EGFR-TKI 요법에 매우 민감한 반응을 보인다. 하지만 종양의 대부분은 이러한 치료법에 대해 내성이 생겨 질환이 진행된다. 승인 받은 EGFR-TKI 치료제인 게피티닙(gefitinib), 엘로티닙(erlotinib)으로 치료 받은 환자의 2/3 가량에서2 차 변이, T790M로 인해 내성이 발생한 것으로 밝혀졌다.
> 타그리소(Tagrisso)에 대하여
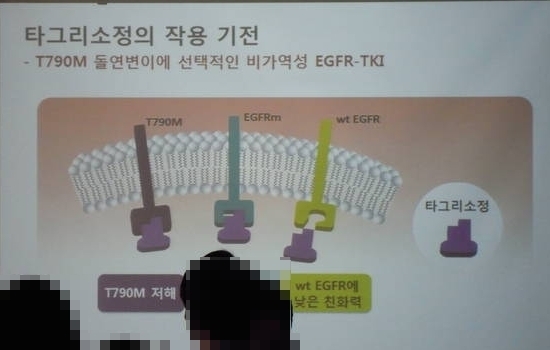
타그리소는 80mg은 1일 1회 투여 정제로 상피세포 성장인자 수용체 티로신 키나제 저해제(EGFR-TKI)로 치료 받은 적이 있는 T790M 변이 양성 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 환자의 치료에 사용이 가능하다. 시험관 비임상 연구 결과에 의하면, 타그리소는 돌연변이 EGFR의 인산화 과정을 효과적으로 억제하며, 임상적으로 의미가 있는 EGFRm과 T790M 변이 양성 비소세포폐암 세포들에 비해 정상형 EGFR 세포주에서는 낮은 효과를 보인다.
> AURA3임상에 대하여
AURA3임상은 이전 EGFR-TKI요법으로 치료받는 중 또는 그 후에 질환이 진행된 EGFR T790M변이 양성 국소 진행성 또는 전이성 비소세포폐암 환자 419명을 대상으로 1일1회 타그리소80 mg 요법의 효과와 안전성을 백금 기반 2제 화학요법과 비교한 임상시험이다. AURA3는 미국, 캐나다, 유럽, 중국, 일본, 한국, 대만, 호주를 포함해 전세계 약 130 여곳에서 진행되었다. 1차 유효성 평가기준은 PFS이며, 이외 평가변수로 OS, ORR, DCR 및 안전성 및 건강관련 삶의 질(HRQoL) 등이 포함된다.
> 아스트라제네카(AstraZeneca)의 항암사업에 대하여
항암 연구는 아스트라제네카가 뿌리깊은 전통을 가진 치료 분야로, 환자들의 삶과 기업의 미래를 변화시킬 수 있는 잠재력을 가진 다양한 약물들을 개발하고 있다. 2014년에서 2020년 사이에 적어도 여섯 가지의 신약 출시와 분자학과 생물학의 폭 넓은 파이프라인을 개척을 통해 폐암, 난소암, 유방암 및 혈액암을 중심으로 항암 연구를 진행하며, 항암부문은 아스트라제네카의 여섯 번째 성장 플랫폼으로 삼고 있다. 뿐만 아니라, AcertaPharma의 혈액암 연구에 협력했던 것처럼, 아스트라제네카의 전략 전달을 가속화하는 혁신적인 파트너십과 투자를 적극적으로 추구할 것이다.
면역항암, 암의 유전적 요인과 내성, DNA 손상 복구 및 항체-약물 결합체, 4 가지 과학적 플랫폼을 원동력으로 삼고 개별화된 복합치료의 개발에 중점을 두어, 아스트라제네카는 항암 치료의 새로운 지평을 열고 언젠가 암으로 인한 사망을 뿌리뽑는 것을 비전으로 한다.
> 아스트라제네카(AstraZeneca) 소개
아스트라제네카는 세 개의 주요 질환 분야 - 호흡기, 감염 및 자가면역 질환(RIA), 심혈관 및 신진대사 질환(CVMD), 암 – 뿐만 아니라 전염병 및 신경과학질환 등의 치료제를 주로 발굴, 개발 및 상용화하는 글로벌 혁신 주도의 바이오 제약 회사다. 아스트라제네카는 세계 100여 국에서 사업을 추진하고 있고 전세계 수천만 명의 환자들이 아스트라제네카의 혁신적인 의약품으로 치료 받고 있다.
더 상세한 정보는 www.astrazeneca.com 에서 확인할 수 있다.
