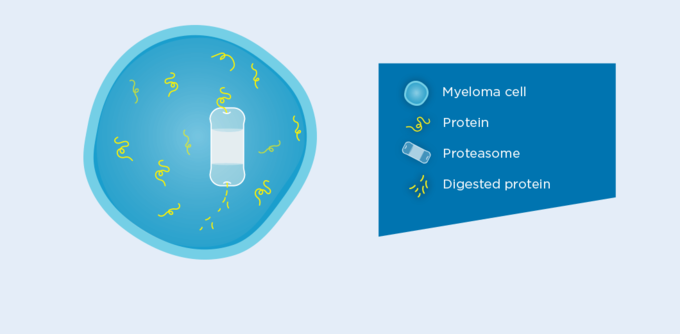
닌라로, 첫 번째 경구용 프로테아좀 억제제1
닌라로, 레날리도마이드 및 덱사메타손 3제요법으로 무진행 생존기간 유의하게 연장2
한국다케다제약 (대표 마헨더 나야크, 이하 “다케다제약”)은 7월 31일 닌라로(익사조밉)가 식품의약품안전처로부터 이전에 한 가지 이상의 치료를 받은 다발골수종 환자에서 레날리도마이드 및 덱사메타손과의 병용요법으로 허가를 받았다고 밝혔다.3
닌라로는 첫 번째 경구용 프로테아좀 억제제로 재발성 또는 불응성 다발골수종 환자를 대상으로 그 효과가 입증되었으며, 프로테아좀과 가역적으로 결합하여 억제한다.1
한국다케다제약 마헨더 나야크 대표는 “닌라로의 국내 허가는 환자들을 위한 혁신적인 신약 개발을 위한 다케다의 끊임없는 노력과 투자의 또 다른 예시”라며, “닌라로는 첫 번째 경구용 프로테아좀 억제제로서 다발골수종 환자들의 무진행 생존기간을 유의하게 개선함은 물론, 복약편의성을 높여 환자들의 삶의 질 개선에 기여할 수 있을 것으로 기대한다. 1,2”고 말했다.
닌라로는 권장 시작 용량 4mg으로 28일 주기의 제 1, 8, 15일에 경구 투여한다. 레날리도마이드는 25mg으로 시작할 것이 권장되며 28일 주기의 1일부터 21일까지 매일 1회 경구 투여한다. 덱사메타손의 권장 시작용량은 40mg으로 28일주기의 1, 8, 15, 22일에 주 1회 경구 투여한다.3
식약처의 이번 시판 허가는 재발성 또는 불응성 다발골수종 성인환자 722명을 대상으로 한 닌라로의 무작위 이중맹검 3상 임상시험 결과(TOURMALINE-MM1 연구)에 의거해 이뤄졌다.
임상 결과 ‘닌라로 + 레날리도마이드 + 덱사메타손’ 병용투여군이 ‘위약 + 레날리도마이드 +덱사메타손” 병용투여군에 비해 무진행 생존기간(PFS)을 약6개월(중앙값) 연장시켰다. (닌라로 투여군-median PFS: 20.6개월, 위약 투여-median PFS: 14.7개월, HR=0.74, p=0.01). 이번 임상시험의 경과관찰 중앙값은 약 23개월이었으며 전체 생존율(OS)의 중앙값은 두 군 모두에서 아직까지 도달하지 않은 상태이며, 경과를 관찰 중이다.2
닌라로는 지난해 5월 국내 식품의약품안전처로부터 희귀의약품으로 지정 받은 바 있다.4
다발골수종은 면역세포의 일종인 형질세포에 의해 발생하는 질환이다. 혈액 질환임에도 불구하고 골절 및 골다공증이 동시에 나타나는 것이 주요 증상 중 하나다. 다발골수종은 인종 및 지역별 발병률에 차이를 보이며 서양의 경우 평균 10만 명당 5.6명, 아시아 국가는 1~3명 정도로 동양계에서 더 낮은 발병률을 보인다.5 통계청에 따르면 국내의 다발골수종 환자 수는 2014년 기준 1,396명이다. 6
다발골수종(Multiple Myeloma) 에 대하여
다발골수종(Multiple myeloma)은 형질세포(plasma cells)에서 발생하는 혈액 암으로 골수에서 발견된다. 다발골수종은 일단의 형질 세포, 또는 골수종 세포들이 종양을 만들고 증식하며 형질세포의 수를 기준치보다 증가시킨다. 형질세포가 체내를 광범위하게 순환하기 때문에 이들은 인체의 뼈에 영향을 미칠 가능성이 있으며, 따라서 압박골절, 뼈 용해 및 관련 통증을 유발할 수 있다. 다발골수종은 뼈와 면역체계, 신장 및 개인의 적혈구 수에 영향을 미쳐 심각한 문제를 야기할 수 있으며, 자주 나타나는 증상으로는 뼈 통증과 피로, 빈혈 등이 있다. 다발골수종은 매년 세계적으로 11만 4,000건이 새로 발생하고 있다. 일본 내에서는 약 1만 4,000 명의 다발 골수종 환자가 보고되었다.
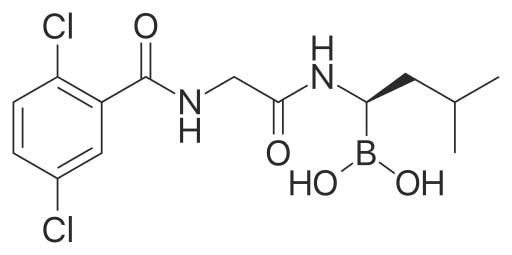
익사조밉(Ixazomib)에 대하여
익사조밉은 다발골수종 환자를 대상으로 임상연구를 진행중인 새로운 경구용 프로테아좀 억제제다. 익사조밉은 2016년 2월 일본 후생노동성이 재발성 또는 불응성 다발골수종 환자의 치료를 위한 희귀의약품으로 지정했다. 미국에서는 TOURMALINE-MM1임상 결과를 바탕으로 2015년 7월 식품의약국(FDA)에 신약승인신청서를 제출하여, 전문의약품 허가신청자 비용부담법(PDUFA)에 따른 ‘우선심사’일 4개월 전인 2015년 11월에 이전에 하나 이상의 치료에 실패한 다발골수종 환자 치료제로 승인 받았다. 이에 따라 익사조밉은 ‘닌라로®’ 라는 상품명으로 미국에서 2015년 12월에 출시됐다.
TOURMALINE-MM1 연구에 대하여2
TOURMALINE-MM1 연구는 이중맹검, 위약-대조 임상시험으로 722명의 환자가 참여한 경구용 프로테아좀 억제제의 첫 번째 3상 임상시험이다. 뉴잉글랜드 저널오브 메디슨(NEJM)에 게재된 바에 따르면, 임상 결과 위약군 무진행생존기간(PFS) 중앙값은 14.7개월이었던 반면, 익사조밉군의 무진행생존기간 중앙값은 20.6개월로(HR= 0.74; p = 0.01) 무진행생존기간을 35% 연장하여, 통계적으로 유의하고 임상적으로 의미가 있는 결과를 보여주었다(경과관찰 중앙값 14.7개월). 익사조밉 병용군 중 연령이 높은 환자, 2~3차례 치료 전력이 있는 환자, 다발골수종 병기 분류 등급이 높은 환자, 세포유전학적 변이의 높은 위험이 있는 환자 등과 같이 좋지 않은 예후를 가진 환자가 포함된 하위그룹에서도 무진행생존기간의 이점이 관찰됐다. 전체 치료반응률은 익사조밉군 78% 대비 위약군은 72%이고, 매우 우수한 부분반응률 이상(≥VGPR)은 48% 대비 39%였다. 각 실험군에서 반응을 보이기까지 걸린 시간의 중앙값은 익사조밉군이 1.1개월, 위약군이 1.9개월로 나타났으며, 반응 지속기간(DOR) 중앙값은 각각 20.5개월과 15.0개월이었다. 익사조밉군과 위약군에서 심각한 이상반응의 빈도(47% 대비 49%)와 연구 중 사망 비율(4% 대비 6%)은 유사하게 나타났으며, 익사조밉군 74%, 위약군 69%의 환자가 3등급 이상의 이상반응을 경험했다. 3, 4등급의 혈소판감소증은 위약군(5%, 4%)보다 익사조밉군(12%, 7%)에서 더욱 자주 발생했다. 발진도 위약군보다 익사조밉군에서 더욱 자주 발생했으며(익사조밉군 36%, 위약군 23%), 위장관련 이상반응 또한 더 자주 발생했으나, 대부분 낮은 등급이었다. 말초신경병 발생률은 익사조밉군에서 27%, 위약군에서 22%로 나타났다(각 그룹 에서 2%의 환자가 3등급의 질병이 발병했으나, 4등급 환자는 없는 것으로 보고됐다.)
References
1 Offidani M et al, An evidence-based review of ixazomib citrate and its potential in the treatment of newly diagnosed multiple myeloma. OncoTargets and Therapy, 2014;7:1793–1800
2 P.Moreau, et al. Oral Ixazomib, Lenalidomide, and Dexamethasone for Multiple Myeloma. The New England Journal of Medicine, 2016; 374(17):1621-1634
4 식품의약품안전처 고시 제2016-35호
5 윤성수 외, 19 다발골수종, 김시연, 종양학; 서울, 일조각, 2012:844-862