단백질 Anks1a의 세포막 단백질 HER2 레벨 조절 메커니즘 밝혀내
Anks1a regulates COPII-mediated anterograde transport of receptor tyrosine kinases critical for tumorigenesis

미래창조과학부(장관 최양희)는 국내 연구진이 유방암 및 조현병 발병과 연관되어 있는 단백질 HER2 이상 발현이 단백질 Anks1a*에 의하여 조절되는 핵심 메커니즘을 규명하였다고 밝혔다.
* Anks1a : 세포질에서 발현하는 단백질로 많은 종류의 세포에서 발현된다. 특히, 암세포 및 뇌실막세포에서 강하게 발현되며 암, 조현병, 자폐증 환자에게서 Anks1a의 다양한 돌연변이가 보고되었다. Eph 카이네즈 수용체 및 EGF 수용체와 상호작용하며 암발생과 뇌발달질환과 연관되어 있는 것으로 보고되었다.
숙명여자대학교 박수철 교수팀의 이번 연구 결과는 다학제 과학 분야의 세계적인 학술지 Nature Communications (IF 11.329, JCR 분야 상위 4.76% 해당)온라인판 9월 13일자에 게재되었다.
조현병은 전세계 인구 중 0.3~0.7%에서 나타나는 뇌발달질환 중 하나로 조현병 환자들은 망상이나 환각과 같은 증상을 보이며 언어와 행동에 문제가 생기는 경우도 있다. 그동안 조현병의 발병 원인으로 HER2 유전자 과잉발현을 포함한 여러 가지 요인들이 보고되고 있으나 아직까지 확실하지는 않았다.
세포막 카이네즈 수용체 HER2가 유방암이나 조현병과 같은 인간질환을 유발한다는 연구결과는 잘 알려져 있으며, 최근에는 HER2의 과잉발현에 EphA2 수용체가 중요하게 관여하는 것으로 보고되었으나, HER2, EphA2 카이네즈 수용체가 어떠한 수송 메커니즘을 통하여 세포표면으로 이동하는지는 밝혀지지 않았었다.
* HER2/EphA2와 유방암 : 유방세포에서 HER2를 과잉발현시킨 돌연변이 쥐는 약 8개월 이후부터 유방암이 나타난다. 하지만, 돌연변이 쥐에서 EphA2 유전자를 결손시키면 유방암 발병률이 크게 감소하고, HER2에 의한 Ras-Erk-mTOR 신호가 약해진다. 따라서 HER2 수용체에 의한 유방암 발병은 EphA2 수용체와의 상호작용을 통하여 이루어지는 것으로 추정된다.
이에 박수철 교수팀은 단백질 Anks1a가 특정 수용체(HER2, EphA2)의 수송을 촉진하여 HER2/EphA2의 양을 과잉 발현하게 하여 유방암 및 조현병과 같은 질환을 유발한다는 것을 최초로 규명하였다.
소포체에서 발현된 후 수송소포에 실려 세포막으로 수송된 HER2, EphA2 수용체의 수위가 지나치게 높아지면 Ras-Erk-mTOR 신호가 지속적으로 활성화되어 유방암이나 조현병이 유발되는 것으로 알려져 있다.
* 소포체 및 골지 : 소포체는 수용체를 만드는 세포 내 소기관이다. 소포체에서 만들어진 수용체는 수송 소포에 실려 골지로 이동하고 골지로부터 또 다시 수송 소포에 실려 세포막으로 이동한다. 소포체 및 골지를 통한 수송 과정 중에 수용체는 적절한 구조로 변경 된다.
본 연구진은 Anks1a의 발현이 결핍된 세포나 동물에서는 HER2, EphA2 수용체가 과잉발현 되더라도 소포체에서 나가지 못하기 때문에 세포막에 존재하는 수용체의 양이 크게 줄어든다는 것을 밝혔다.
최근 암, 조현병, 자폐증 환자에게서 Anks1a 유전자 돌연변이가 많이 보고되고 있다. 이는 HER2의 인간질환 유발 메커니즘에서 Anks1a 기능 변화가 핵심역할을 할 수 있음을 제시하고 있다.
박수철 교수는 “이번 연구 결과는 유방암, 조현병 환자에서 관찰되는 HER2의 이상 발현에 Anks1a 단백질이 중요하게 작용한다는 새로운 발견이며, 조현병, 자폐증 등 뇌발달질환에 관한 새로운 진단법과 치료법 개발에 기여할 것이다.”라고 연구의 의의를 설명했다.
본 연구는 미래창조과학부가 지원하는 뇌과학원천기술개발사업 으로 수행되었으며 향후 Anks1a와 HER2, EphA2 수용체 간의 상호 작용을 억제할 수 있는 후속연구를 진행할 예정이다.
논문의 주요 내용
□ 논문명, 저자정보
ㅇ 논문명 : Anks1a regulates COPII-mediated anterograde transport of receptor tyrosine kinases critical for tumorigenesis
ㅇ 저자 정보 : 박수철 교수(교신저자, 숙명여대), 이혜령 박사(제1저자, 숙명여대), 노현아 박사(공동저자, 숙명여대), 문지영 박사(공동저자, 을지대), 구창규 박사 (공동저자, 미국 메사추세츠 종합병원), Sanja Sever 박사(공동저자, 미국 메사추세츠 종합병원)
□ 논문의 주요 내용
1. 연구의 필요성
수용체는 소포체 (endoplasmic reticulum, ER)에서 만들어진 다음 골지체(Golgi)를 경유하여 세포 표면으로 이동한다. 세포 표면에 도달한 수용체는 외부 자극에 반응하여 세포의 다양한 행동을 조절한다. 반면에 이러한 수용체의 비정상적 발현은 암 또는 정신병의 발병원인으로 제시되고 있다.
HER2 (Neu, ErbB2) 수용체의 과잉발현은 유방암, 조현병 등과 같은 인간질병의 원인으로 알려져 있다. 예를 들어 허셉틴 (Herceptin)은 현재 시판 되고 있는 유방암 치료제로서 HER2 수용체에 결합하여 그 기능을 억제하는 것으로 잘 알려져 있다.
따라서 세포표면에 존재하는 HER2 수용체의 양 조절에 관한 이해는 암을 포함한 다양한 인간 질병을 극복할 수 있는 중요한 기술을 제공할 전망이다. 하지만 소포체에서 HER2 수용체가 세포표면으로 수송되는 기작이 어떻게 조절되는지에 관한 연구는 아직까지 알려진 내용이 없다.
2. 발견 원리
Anks1a는 세포질 단백질이지만 인산화되면 소포체 (endoplasmic reticulum, ER)로 이동하여 특정 종류의 단백질 수용체의 수송을 조절한다.
소포체에서 Anks1a는 EphA2 수용체 및 Sec23와 결합하여 수송 소포에 EphA2가 잘 들어가게 함으로써 단백질 수송을 촉진한다. 또한 EphA2는 소포체에서 HER2와 결합하여 안정화를 증가시키고 HER2 수용체의 수송을 도와준다.
그 결과 Anks1a 유전자가 결손된 세포 및 동물에서 EphA2 및 HER2 단백질의 양이 세포표면에서 크게 감소된다. 이러한 이유 때문에 Anks1a 적중 마우스는 HER2 과잉발현에도 불구하고 유방암에 잘 걸리지 않는다.
이러한 연구결과는 Anks1a 단백질의 적절한 제어기술이 암과 조현병을 포함한 여러 종류의 인간질환을 치료할 수 있는 새로운 원천기술임을 제시하고 있다.
3. 연구 성과
본 연구결과는 그동안 잘 알려지지 않은 EphA2 및 HER2 카이네즈 수용체 과잉발현의 새로운 원인을 규명한 것으로 암에 대한 새로운 치료 타겟을 제시할 수 있게 되었다.
본 연구결과를 바탕으로 조현병 및 자폐증 환자에게서 발견된 Anks1a 돌연변이의 기능 연구가 가능해 졌으며, 이를 통하여 뇌발달질환 유발기전 원인 및 치료법 개발에 큰 기여를 할 것이다.
연 구 결 과 개 요
1. 연구배경
HER2 수용체는 유방암뿐만 아니라 조현병 등과 같은 뇌 발달질환의 원인 유전자로 알려져 있다. 또한 EphA2 카이네즈 수용체는 HER2와 상호작용하여 HER2 수용체에 의한 Ras-Erk-mTOR 신호를 강화시키는 역할을 한다고 알려져 있다.
세포 표면에 비정상적으로 많이 존재하는 HER2 수용체는 세포분열을 촉진하여 암과 뇌발달질환을 유발하는 것으로 생각되고 있다. Herceptin은 유방암 환자에게서 과잉 발현되는 HER2 수용체를 억제하는 대표적인 암 치료제다.
반면에 HER2 수용체가 과잉발현되더라도 소포체에서 단백질의 품질과 폴딩이 적절히 일어난 다음에 수송소포에 실려 골지를 거쳐 세포막으로 이동해야 한다. 따라서 소포체에서 HER2 수용체의 수송에 관한 원리 이해는 암과 뇌발달질환 유발기전 원인 및 치료법 개발에 매우 중요할 것으로 생각된다.
2. 연구내용
Anks1a는 세포질 단백질이지만 Erk에 의하여 인산화되면 소포체로 이동한다.
소포체에서 Anks1a는 EphA2 수용체와 Sec23와 결합한다. 이러한 상호작용은 EphA2 수용체가 수송소포 안으로 포장되는 데 매우 중요하다.
암세포에서 Anks1a 단백질이 많이 발현되는데 이러한 발현을 억제하면 세포 표면으로 수송되는 EphA2 수용체가 감소하고 암세포의 특성이 상실된다.
HER2를 과잉 발현하는 생쥐는 약 8-12개월이면 유방암을 형성하게 된다. 하지만 HER2 수용체가 과잉발현 되더라도 Anks1a 유전자가 결실되면 유방암 발병이 급격히 감소한다.
소포체에서 HER2는 EphA2와 상호 결합하여 안정화가 증가하고 수송소포안으로 포장되어 세포표면으로 이동한다. 따라서 Anks1a 유전자가 결실되면 EphA2 수용체 수송은 물론이고 HER2 수용체 수송도 감소하여 세포막에서 HER2 수용체는 거의 발견되지 않는다.
3. 기대효과
Herceptin은 대표적인 유방암 치료제로서 세포표면에 존재하는 HER2를 억제하는 항체약물이다. Herceptin에 저항하는 환자들의 경우 새로운 항암치료제가 필요하지만 아직 효과적인 치료제는 없는 실정이다. 본 연구결과는 HER2, EphA2 수용체의 수송 조절 기작 제어가 유방암을 치료할 수 있는 새로운 타겟임을 제시하고 있다.
HER2는 뇌발달과정 동안 방사교세포에서 발현하여 세포분열을 조절한다. HER2 과잉발현은 신경세포수를 증가시켜 신경회로 및 시냅스 형성에 문제를 일으켜 조현병과 같은 소아기 정신질환을 유발하는 것으로 알려져 있다. 또한 조현병과 자폐증 환자에게서 Anks1a 돌연변이가 보고된바 있다. 본 연구결과는 HER2, EphA2 수용체의 수송 조절 기작 제어가 조현병과 같은 뇌발달질환을 이해하고 치료할 수 있는 새로운 타겟임을 제시하고 있다.
연구 이야기
□ 연구를 시작한 계기나 배경은?
본 실험실에서 Anks1a는 Eph 수용체와 결합하는 adaptor 단백질로 발견되었고, 세포막에서 EphA 수용체 신호 조절에 관여한다고 보고하였다. 하지만 세포막에 존재하는 Anks1a 양은 매우 적고 오히려 일부가 소포체에 존재하는 것을 발견하게 되었다. 따라서 “Anks1a는 소포체에서 발현된 EphA 수용체의 단백질 수송에 관여하지 않을까?”라는 가설을 설정하게 되었다.
□ 연구 전개 과정에 대한 소개
Anks1a 단백질은 EGF 수용체 및 Eph 수용체의 신호전달에 관여하는 adaptor단백질로 알려졌다. 또한 Anks1a는 인산화 단백질이며 다양한 세포질 단백질과도 상호작용한다고 보고되었다. 본 연구진은 Anks1a 단백질의 인산화가 소포체로 이동하는데 중요하고 이러한 과정이 EphA2 수용체와 결합하는데 중요한 모멘텀을 제공한다는 것을 밝혔다. 또한 Anks1a는 Sec23와 결합하는데 Sec23는 수송소포에 단백질을 포장하는 과정에 관여한다. 따라서 Anks1a는 EphA2 수용체를 수송세포에 로딩하는데 매우 중요한 인자라는 가설을 설정할 수 있었고, 우리의 실험결과는 이러한 가설을 잘 입증하였다. 사실 본 연구진은 오래전부터 Anks1a 유전자 결손이 HER2 과잉발현에 의한 유방암 발병을 억제한다는 연구 결과를 갖고 있었다. 소포체에서 Anks1a에 의한 EphA2 수용체 수송조절이 결국 HER2 수용체의 안정화와 수송에도 영향을 준다는 것을 밝히게 되었고, 궁극적으로 Anks1a 기능조절이 수용체 과잉발현에 의하여 발병되는 인간질환을 억제할 수 있다는 새로운 사실을 제시하게 되었다.
□ 연구하면서 어려웠던 점이나 장애요소가 있었다면 무엇인지?
본 논문을 제출하고 첫 번째로 받은 심사 과정에서 세 명의 리뷰어로부터 다양한 추가 실험을 요구받았다. 3개월이라는 짧은 기간 동안 추가 실험을 완료하기란 쉽지 않은 일이었다. 더구나 이 기간 중에 실험실의 환경개선 공사가 겹치며 더욱 난감한 상황에 처했었다. 실제로 실험이 가능한 시간은 2개월 남짓이었지만 짧은 시간동안 집중하여 실험에 매진하여 결과들을 얻을 수 있었다.
□ 이번 성과, 무엇이 다른가?
본 연구결과는 HER2, EphA2 수용체의 수송 조절 기작 제어가 유방암을 치료할 수 있는 새로운 타겟임을 제시하고 있으며 향후 조현병과 같은 뇌발달질환 유발기전 원인 및 치료법 개발에 중요한 단서를 제공하고 있다.
□ 꼭 이루고 싶은 목표와, 향후 연구계획은?
본 연구결과를 바탕으로 Anks1a와 Sec23 또는 Anks1a와 HER2, EphA2 수용체 간의 상호작용을 억제할 수 있는 펩티드 또는 폴리펩티드를 분석하고자 한다. 이는 Anks1a에 의한 수용체 수송 조절을 억제하여 암 또는 뇌발달질환의 치료제 개발에 유용할 것이다.
□ 기타 특별한 에피소드가 있었다면?
본 논문을 제출하기 위해 다양한 실험들을 경험할 수 있었다. 2013년 노벨상 수상자인 Randy Schekman이 고안한 ‘in vitro COPII vesicle budding assay’가 대표적이다. 세포 밖에서 세포 안의 소포 제작을 재현하는 기술로 Randy Schekman에게 직접 실험에 필요한 플라스미드와 실험 방법을 전해 받아 실험을 진행하였다. 하지만 생소한 실험 기술로 처음에는 원하는 결과를 쉽게 얻을 수 없었고 몇 번의 실패를 경험할 수 밖에 없었다. 그럼에도 포기하지 않고 계속 도전한 결과, 논문을 게재하는 데 중요한 핵심 데이터들을 얻어낼 수 있었다.
용 어 설 명
1. 네이처 커뮤니케이션스 (Nature Communications)
.
네이처 커뮤니케이션스는 다학제 과학분야 (multidisciplinary sciences)에서 상위 4.76% (IF 11.329, 2015년 기준)에 속하며, Nature, Science 다음으로 권위 있는 세계적 SCI 학술지이다.
2. HER2 및 EphA2 카이네즈 수용체
. 수용체란 세포막에 존재하는 단백질로 세포 외부에 존재하는 특정 리간드와 선택적으로 결합하여 활성화되는 세포막 단백질을 말한다. 수용체가 활성화되면 종류에 따라 세포 내에 다양한 신호를 전달하고 유전자 발현까지 조절하여 세포의 여러 가지 행동을 조절 한다.
. HER2 카이네즈 수용체의 과잉발현은 유방암의 중요한 원인중의 하나이다. HER2 수용체는 Ras-Erk-mTOR 신호를 증가시켜 세포들의 과다 증식을 유발하게 되는데 Herceptin은 이러한 HER2를 억제하는 유방암 치료제로 시판되고 있다.
. 최근 연구는 HER2에 의한 신호는 EphA2 수용체를 필요로 하는 것으로 보고 되고 있다. 예를 들어 EphA2 유전자가 결손되면 HER2 과잉발현에 의한 유방암 발병이 크게 감소하는 것으로 알려져 있다.
3. Anks1a adpator 단백질
. Anks1a는 세포질에서 발현하는 단백질로, EphA 수용체 및 EGF 수용체와 상호작용하는 것으로 알려져 있다. Anks1a는 Ankyrin, SAM, PTB 도메인을 갖고 있는 인산화 단백질이며 많은 종류의 세포에서 조금씩 발현되며 암세포 및 뇌실막세포 (ependymal cell)에서 특히 강하게 발현된다. Anks1a의 돌연변이가 암, 조현병, 자페증 환자에게서 보고되고 있으므로 인간질환발병에 중요하게 작용할 것으로 추정된다.
4. Ras-Erk-mTOR 신호
. 원종양단백질(proto-oncoprotein)의 한 종류인 Ras는 GTP 결합 단백질로 불활성형(GDP결합형)과 활성형(GTP결합형)이 존재한다. 활성화된 Ras는 MAP인산화효소를 단계적으로 활성화하여 Erk (MAP) 신호를 통해 세포 증식을 촉진시킨다.
. 라파마이신(rapamycine)의 표적 단백질로 알려진 mTOR는 단백질 인산화 효소로써 세포 성장, 세포 증식, 세포 운동성, 세포 생존, 단백질 합성, 전사를 조절한다.
. Ras-Erk 신호는 간접적으로 mTOR 신호를 활성화시키며 이러한 신호가 지나치게 많아지면 암과 같은 질병이나 뇌발달질환을 일으키는 것으로 잘 알려져 있다.
5. 수용체(Receptor)의 소포체 발현과 세포막으로의 이동
. 세포질에 존재하는 단백질과 달리 세포막에서 기능하는 여러 단백질들은 소포체(Endoplasmic Reticulum, ER)라는 세포소기관에서 만들어진다. 그리고 소포(vesicle)에 싸여 소포체에서 나와 골지체(Golgi)로 운반된다. 수용체는 소포체에서 만들어 지고 골지체를 통과하면서 구조적인 변화를 갖게 되고 이렇게 성숙된 수용체는 세포막에 도달하여 적절한 기능을 수행하게 된다.
. 수용체 유전자의 전사가 높아서 mRNA가 많이 만들어지더라도 소포체 리보좀에 의하여 만들어진 수용체 단백질이 수송소포에 실려 세포막으로 이동하는 과정에 문제가 생기면 세포막에 존재하는 수용체 레벨에 큰 변화가 있게 되고 이러한 것이 인간질병을 유발하는데 매우 중요할 수 있다.
그 림 설 명
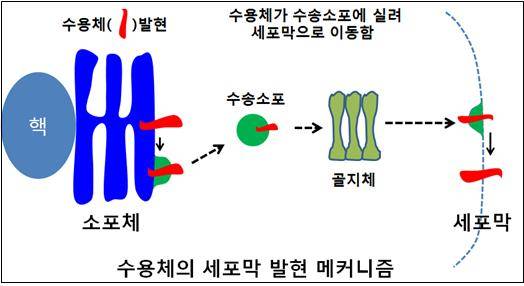
그림1. 수용체의 세포막 발현 메커니즘.
수용체는 세포막 단백질이기 때문에 먼저 소포체에서 발현된다. 적절히 폴딩된 수용체는 수송세포에 실려 골지체로 이동하고 결국에는 세포막으로 이동하게 된다. 소포체와 골지체를 거치면서 수용체의 구조등이 변화하게 되며 이러한 과정을 거치면서 세포막으로 이동한 수용체는 적절하게 작동할 수 있다.
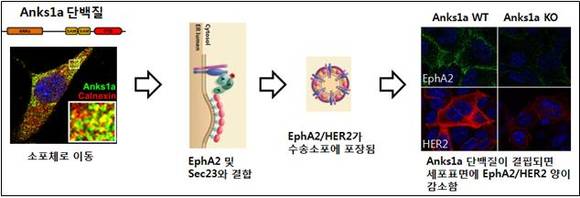
그림2. Anks1a의 카이네즈 수용체 수송 기전
Anks1a 단백질은 주로 세포질에 있으나 성장인자를 포함한 외부 자극에 의해 인산화되면 소포체로 이동하게 된다. 소포체에서 EphA2/HER2와 같은 특정 수용체와 결합하고 Sec23와 협조하여 소포 안에 수용체가 잘 포장되게 도와준다. 따라서 Anks1a의 기능 저하는 세포 표면의 수용체의 양을 감소시킬 수 있으며 Anks1a를 제어할 수 있는 원천기술은 암, 조현병 등과 같은 인간질환 발병 기전을 이해하고 치료법 개발에 기여할 것이다.
* 박수철 교수 (교신저자) 이력사항
1. 인적사항
○ 소 속 : 숙명여자대학교 생명과학부 정교수
○ 전 화 : 02-710-9330
○ e-mail : scpark@sookmyung.ac.kr
2.학력
○ 1982-1986년 학사, 서울대학교 미생물학과
○ 1986-1988년 석사, 서울대학교 미생물학과
○ 1988-1993년 박사, University of Michigan Medical School, Ann Arbor, MI
3.경력사항
○ 1993-1997년 연구원, 미국 브리스톨마이어스 제약회사 연구소 (Bristol-Myers Squibb Pharmaceutical Research institute)
○ 1997-2002년 한림대학교 조교수, 부교수
○ 2002-2006년 숙명여자대학교 부교수
○ 2006~ 현재 숙명여자대학교 정교수
○ 2006-2007년 The Salk Institute, 방문 교수
○ 2011-2013년 소장, 숙명여자대학교 여성건강연구소
○ 2013~ 현재 뇌신경과학회 Experimental Neurobiology 부편집장
4.연구지원정보
○ 2013년~2018년 : 미래창조과학부 뇌과학원천기술개발사업
※ mTOR 신호전달계 기반 뇌발달 제어인자 발굴, 기전규명 및 치료기술 개발
* 이혜령 박사 (제1저자) 이력사항

1. 인적사항
○ 소 속 : 숙명여자대학교
○ 전 화 : 02-710-9330
○ e-mail : frentoby@sookmyung.ac.kr
2.학력
○ 2005-2009년 학사, 숙명여자대학교 생명과학과
○ 2009-2015년 박사, 숙명여자대학교 생명시스템학과, 석박통합과정
3.경력사항
○ 2015~ 현재 숙명여자대학교 여성건강연구소 박사 후 연구원
