
테노포비르 표적화 전구약물 베믈리디®,
보다 효율적으로 간세포에 약효성분 전달 가능
비리어드® 1/10 용량 25mg으로 비열등한 항바이러스 효과,
신장 및 골 안전성 비교우위 입증
길리어드사이언스, 만성 B형간염 환자의 미 충족 요구 해소하기 위한 노력 지속할 예정
길리어드 사이언스 코리아(대표이사 이승우)는 만성 B형간염 치료제 베믈리디®(Vemlidy®, 성분명 테노포비르 알라페나미드)가 식품의약품안전처 허가를 받고 국내 출시됐다고 밝혔다. 베믈리디®는 성인의 만성 B형간염 치료에 대해 1일 1회 1정을 식사와 함께 복용하는 적응증으로 국내 허가를 획득했다.
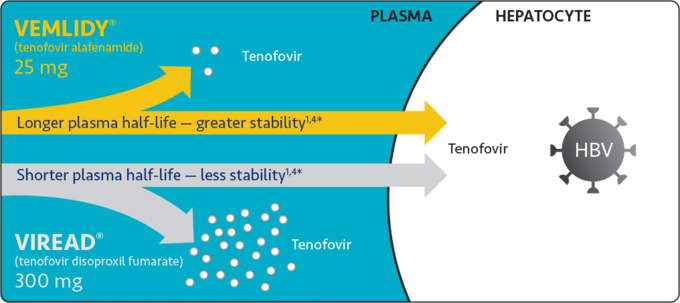
베믈리디®는 새로운 테노포비르 표적화 전구약물로 비리어드® 300mg에 비해 10분의 1 이하의 적은 용량인 25mg으로 비열등한 항바이러스 효능을 발휘한다. 베믈리디®는 혈장 안정성이 향상되어 비리어드® 보다 효율적으로 간세포에 약효성분인 테노포비르를 전달할 수 있기 때문에 투여량을 낮출 수 있다. 결과적으로 베믈리디®는 혈장 내 테노포비르 농도를 비리어드® 대비 89% 감소시켜 약물 전신노출을 줄였고1 이에 따라 신장 및 골 안전성 측면에서도 비리어드®에 비해 우위를 보였다.
베믈리디®는 향상된 안전성에 따라 경증, 중등증 또는 중증 신 장애 환자에서 용량 조절이 필요하지 않다. 또한 경증 간 장애(child Pugh A) 환자에서도 용량 조절이 필요 없다. 말기 신 장애 환자(크레아티닌 청소율 추정치 15mL/min 미만) 또는 간 경변 환자에서는 사용이 권장되지 않는다 .
길리어드 사이언스 코리아 의학부 반준우 전무는 “만성 B형간염 환자들이 고령화 되면서 환자의 현재와 미래를 아우르는 효과적인 치료법의 필요성이 부각되고 있다”며, “베믈리디®는 비리어드®에 비열등한 항바이러스 효능을 발휘하면서, 혈중 ALT 수치 정상화에 도달한 환자는 비리어드® 보다 많았고, 신장 및 골 안전성을 개선해 장기간 안전성을 높인 최신 치료제다”라고 말했다.
베믈리디®, 비리어드®에 비열등한 항바이러스 효과 유지하면서 우수한 골 및 신장 안전성 입증
베믈리디®는 22개 국가 220개 기관에서 모집된 치료경험이 없거나 치료경험이 있는 성인 만성 B형간염 환자 1,298명을 대상으로 48주 동안 베믈리디® 또는 비리어드®를 복용토록 하면서 진행되었던 다국적, 무작위 배정, 이중맹검, 활성 대조군, 비열등성 연구 2편의 통합분석 결과를 토대로 유효성과 안전성을 평가 받아 승인을 획득했다.
108 임상시험은 425명의 B형간염 e항원(HBeAg) 음성 환자, 110 임상시험은 873명의 B형간염 e항원(HBeAg) 양성 환자들을 대상으로 했다. 연구 약물 이외에 다른 뉴클레오사이드, 뉴클레오타이드 또는 인터페론 투여는 허용되지 않았다. e항원 음성 환자의 72%, e항원 양성 환자의 83%가 아시아인이었다.
48주차에 혈중 B형간염 바이러스 DNA 수치가 29 IU/mL 이하로 나타난 만성 B형간염 환자들의 비율을 지표로 평가한 결과 베믈리디®는 비리어드® 대비 비열등성(non-inferiority)을 입증했다.
ALT 수치가 정상치로 회복된 환자의 비율은 베믈리디® 복용군이 대조군 보다 높은 것으로 집계됐다. 48주의 임상시험 기간 동안 내성은 한 건도 발생하지 않았다.
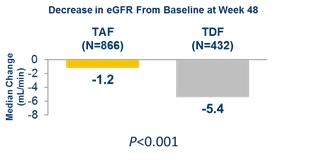
베믈리디®를 복용한 환자들은 비리어드 대조군에 비해 사구체여과율 추정치(eGFRCG)와 혈청 크레아티닌(sCr)의 변화가 유의하게 적었다. 기저선의 사구체여과율(eGFR)이 106mL/min인 성인 만성 B형간염 환자에서 48주째 혈청 크레아티닌(sCr)의 증가는 양 군 모두에서 0.1mL/dL 미만이었으며, 기저선 대비 사구체여과율(eGFR) 변화는 베믈리디®군에서 -1.2mL/min, 비리어드®군에서 -5.4mL/min이었다.
표 1 사구체여과율(eGFR) 감소율 비교(TAF vs TDF)
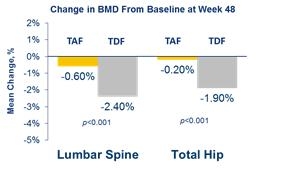
베믈리디® 투여 환자는 48주차에 기저선 대비 척추 및 고관절 골밀도(BMD)의 감소율이 비리어드® 대비 유의하게 감소했다. 골밀도 감소율은 비리어드®에 비해 척추의 경우 75%, 고관절의 경우 89% 개선된 것으로 나타났다.
표 2 척추 및 고관절 골밀도(BMD) 감소율 비교(TAF vs TDF)
베믈리디® 또는 비리어드®를 복용한 환자들은 양호한 내약성을 보였으며, 부작용으로 인해 복용을 중단한 비율은 각각 1% 및 1.2%로 대동소이하게 나타났다. 가장 빈도 높게 수반된 부작용들로는 두통, 복통, 피로감, 기침, 구역 및 요통 등으로, 베믈리디®와 비리어드®를 복용하는 두 그룹에서 유사한 비율로 관찰됐다.

길리어드 사이언스 코리아 이승우 대표이사는 “길리어드는 만성 B형간염 환자들의 치료방법을 향상시키고, 충족되지 못한 요구를 해결하기 위해 지속적으로 노력을 기울여왔으며 이런 노력을 자랑스럽게 생각한다”며, “만성 B형간염 영역에서 우리의 궁극적인 목표는 완치이며, 환자들에게 도움이 되는 새로운 치료법을 계속해서 개발해 나갈 것이다”라고 강조했다.
한편, 국내 B형간염 유병률은 약 3% 수준이며, 연령별로는 30-50대에서 3~7% 수준으로 다른 연령대 보다 높다 . 국제암연구소는 B형간염 및 C형간염을 간암에 대한 1군 발암물질로 분류하고 있다 . 국립암센터에 따르면 간세포암 발생에서 기여위험도는 B형간염이 68.5%, C형간염은 16.0%로 추정되며 전체 간암발생에서 음주의 기여도는 3.4%로 추정된다 .
회사소개

길리어드 사이언스(Gilead Sciences)는 의약적 요구가 아직 충족되지 않은 분야에서 혁신적인 치료제를 발견하고 개발하여 상용화하는 연구 중심의 바이오 제약회사로, 미국 캘리포니아에 본사를 두고 전세계 38개국(2016년 12월 기준)에 진출해있다.
길리어드사의 사명은 생명을 위협하는 질환으로 고통 받는 환자들의 치료 분야를 발전시키는 것이다. 길리어드 사이언스가 개발한 대표적인 치료제로는 신종플루로부터 전세계를 구원한 것으로 잘 알려져 있는 ‘타미플루(Tamiflu)’, 내성률 0% 만성 B형 간염 치료제 ‘비리어드(Viread)’ 등이 있다.
길리어드 사이언스 코리아(대표 이승우)는 2011년 설립 후 현재 ‘비리어드(만성 B형간염 치료제)’, ‘스트리빌드(HIV 치료제)’, ‘트루바다(HIV 치료제)’, ‘암비솜(항진균제)’, 소발디와 하보니(만성 C형간염 치료제)를 국내에 공급하고 있으며, 현재 임상 진행 중인 글로벌 R&D 파이프라인에 기반한 혁신적인 치료제들을 순차적으로 국내에 도입할 예정이다.
References
1 Lee WA, et al. Antimicrob Agents Chemother. 2005;49:1898-906
2 VEMLIDY Prescribing Information, Foster City, CA: Gilead Sciences, Inc; November 2016
3 Chan HLY, et al. Lancet Gastroenterol Hepatol. 2016;1:185-95
4 Agarwal K, et al. J Hepatol. 2015;62:533-40
5 Murakami E, et al. Antimicrob Agents Chemother. 2015;59:3563-9
6 US Full Prescribing Information. Gilead Sciences, Inc. Foster City, CA. November 2016.
7 Prescribing Information. Gilead Sciences, Inc. 2016.
8 Data on file. Gilead Sciences, Inc. Study 108 CSR.
9 2015 국민건강통계, 제 2부 주요건강통계, VI. 간염
10 IARC. Monographs on the evaluation of carcinogenic risks to humans, volume 100. A review of carcinogen-Part B: biological agents. Lyon: International Agency for Research on Cancer, 2011
11 Shin A, Park S, Shin HR., et al, Population attributable fraction of infection-related cancers in Korea. Ann Oncol 2011; 22:1435-1442.
12 국립암센터. Attributable causes of cancer in Korea in the year 2009. 2013
