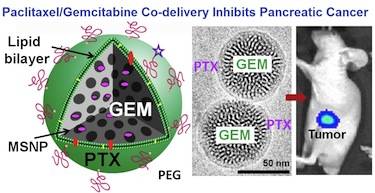
그림. 이중 공격: 췌장암의 치료.
캘리포니아 나노시스템 연구소(California NanoSystems Institute)와 존슨 암 연구센터(Jonsson Comprehensive Cancer Center)의 연구진은 메조다공성 실리카 나노버블과 서로 시너지 효과를 가지는 두 개의 화학 요법 약물을 사용해서 췌장암을 치료할 수 있는 새로운 방법을 개발했다. 이 방법은 현재의 치료 요법만큼 잘 작동하고, 훨씬 더 낮은 용량으로 치료를 할 수 있다.
췌장암은 5년 동안 단지 5%의 생존율을 가진 가장 심각한 암 중 하나이다. 이것은 조기에 검출하기가 어렵고, 증상들이 발견될 때는 이미 너무 늦은 경우가 많고, 화학 요법이 유일한 치료적 선택이다.
젬시타빈(Gemcitabine)이 췌장암 치료에 가장 널리 사용되는 약물이지만, 이것은 제한적인 영향을 끼친다. 과학자들은 젬시타빈과 또 다른 약물인 파클리탁셀(paclitaxel)을 결합하는 것이 치료 성능을 향상시킨다는 것을 최근에 발견했다. 환자들은 아브락산(abraxane, 파클리탁셀이 포함된 나노복합물)과 젬시타빈의 조합으로 치료를 받는다. FDA에 승인된 이런 조합은 어느 정도 치료 효과가 있지만, 두 개 약물의 유익한 효과들이 동시에 완벽하게 발생하지 않기 때문에 여전히 이상적이지 않다.
현재, 이번 연구진은 액체로 코팅된 안정적인 실리카 나노버블 또는 나노입자 캐리어 속에 젬시타빈과 파클리탁셀을 서로 위치시킴으로써 이런 문제를 극복할 수 있는 유망한 방법을 제안했다. 이번 연구진은 혈관 속에 주입될 때 두 개의 약물들이 시너지 효과를 발휘할 수 있도록 적절한 비율로 혼합시켰다. “이 방법은 사용되는 약물의 양을 감소시키고 상조적인 치료 효과를 가질 수 있게 한다”고 Meng가 말했다.
“우리는 수용성 젬시타빈을 캡슐화하기 위해서 지질 코팅된 65nm의 실리카 나노입자를 디자인함으로써 약물 캐리어 속에 대량의 젬시타빈을 탑재할 수 있었다”고 그는 말했다. “이런 코팅은 거의 치사량 수준의 소수성 파클리탁셀을 결합시킬 수 있게 한다. 그 후에 췌장암과 종양에 젬시타빈을 전달할 수 있게 한다”고 그는 덧붙였다.
이번 연구진은 피부 아래에서 성장하는 인간 췌장암을 가진 쥐 속에 실리카 나노버블을 주입했다. 종양이 생리 식염수와 젬시타빈으로 주입한 쥐와 비교했을 때 매우 수축한다는 것을 이번 연구진은 발견했다. 이런 약물 조합은 기존의 표준 치료(젬시타빈만을 사용한 치료)처럼 잘 작동하지만, 단지 1/12의 복용량만을 필요로 한다. 이것은 환자가 부담하는 비용과 부작용을 줄일 수 있다는 것을 의미한다.
이번 연구팀은 복부 속에 인간 췌장암을 수술적으로 삽입한 쥐 속에 나노캐리어를 주입했다. 이것은 췌장암이 발생하는 복부 속에 존재하기 때문에 더 현실적인 상황이다. 새로운 치료를 받은 쥐 속의 종양들은 다른 대조군 속의 종양보다 상당히 더 수축했다. 게다가, 종양들은 주변 장기로 확산되지 않았다.
이번 연구진은 두 개의 서로 다른 작용제가 단일 전달 플랫폼 위에 어떻게 성공적으로 결합될 수 있는지를 보여주었다. 이 방법은 나노입자 기반의 치료에 새로운 가능성을 열어줄 것이다.실리카 나노캐리어가 환자에게 사용되도록 최적화될 필요가 있다고 이번 연구진은 말했다. 이번 연구진은 향후 5년 안에 임상 시험을 수행하기를 원하고 있다.
“한편, 우리는 형질전환된 쥐 모델 속에 이 테스트를 지속적으로 수행하고 있다”고 Nel이 말했다. “우리는 재료 과학자, 생화학자, 제약 분야의 과학자, 외과의, 종양 학자, 독성 학자 등으로 구성된 다학제 팀으로 연구를 수행하고 있다”고 Nel이 덧붙였다. 이 연구는 저널 ACS Nano에 “Use of a Lipid-Coated Mesoporous Silica Nanoparticle Platform for Synergistic Gemcitabine and Paclitaxel Delivery to Human Pancreatic Cancer in Mice”라는 제목으로 게재되었다(DOI: 10.1021/acsnano.5b00510).
