TRPC5 칼슘이온통로의 산화적 스트레스가 헌팅턴질환에 미치는 영향
연 구 결 과
Increased TRPC5 glutathionylation contributes to striatal neuron loss in Huntington’s disease
Chansik Hong*, Hyemyung Seo*, Misun Kwak, Jeha Jeon, Jihoon Jang,
Eui Man Jeong, Jongyun Myeong, Yu Jin Hwang, Kotdaji Ha,
Min Jueng Kang, Kyu Pil Lee, Eugene C. Yi, In-Gyu Kim, Ju-Hong Jeon, Hoon Ryu# and Insuk So#
(Brain, in press)
헌팅턴병(Huntington’s Disease)은 일종의 상염색체 우성(Autosomal dominant)인 신경성 퇴행질환(Neurodegenerative Disease)이다. 대표적인 형태는 운동장애, 인지와 정신혼란이며 일반적으로 병이 발생한 후 10~15년 내에 사망한다.
이 질환의 병리특징은 대뇌 선조 신경세포(Striatal neurons)의 점진적 손실이다. 하지만 헌팅턴 유전자의 돌연변이가 선조 신경세포를 손상시키는 메커니즘이 아직 밝혀지지 않아 치료가 사실상 불가능 한 것으로 알려져 있다.
이전 연구에서 헌팅턴 질환자는 대뇌 선조 신경세포에 산화 스트레스(oxidative stress) 수준이 현저히 높고, 칼슘 항상성에 이상이 발견되었다.
서울의대 생리학교실 서인석 교수 연구팀은 헌팅턴 동물모델과 환자의 선조 신경세포를 이용해 산화스트레스와 신경세포의 사멸 사이의 상관관계를 연구한 결과, 칼슘 항상성 이상을 일으키는 기전을 밝혔고, 원인인자로 ‘TRPC5 칼슘이온통로’를 발견했다.
산화스트레스를 제거하거나 칼슘 항상성을 유지하는 것이 실현가능한 대체 치료방법인데, 칼슘 항상성을 교란할 칼슘이온통로를 발견함으로써 헌팅턴병의 병리특징인 선조 신경세포의 손실을 예방하거나 억제할 수 있게 된 것이다.
정상 세포상태는 산화스트레스를 효과적으로 제거하여 항산화상태를 유지한다. 근데 산화스트레스가 과다 생산되면 세포내 항산화물질인 글루타치온(GSH)이 산화형 글루타치온(GSSG)으로 전환되어 세포내에 축적된다.
이렇게 증가된 산화형 글루타치온이 TRPC5 칼슘이온통로를 산화 손상시킴으로써 이온통로의 활성이 증가되어 세포내 과도한 칼슘이 유입되된다. 다양한 신호전달을 유도할 수 있는 세포내 칼슘이 증가되면서 칼슘 항상성 조절에 문제가 야기되고 신경세포의 사멸과 기능 장애가 유도 되는 것이다.
연구팀은 헌팅턴 쥐 모델에서 TRPC5 칼슘이온통로의 유전적 억제와 약물적 기능 저하를 통해서 정상 선조 신경세포의 증가와 전형적인 행동장애의 개선으로 해당 질환의 임상 경과 및 병리조직학적 소견이 관찰되었다. 헌팅턴 환자에서도 유의하게 산화 손상된 TRPC5 칼슘이온통로의 증가가 일치했다.

연구팀의 홍찬식 박사는 “유전적 질환임에도 성인 이후에 늦게 발병되는 것은 TRPC 이온통로의 발현 양상의 변화가 해당 질환의 증상과 발병시기를 결정할 것이고, 이것은 헌팅턴병에 대한 조기 진단법의 진전 가능성을 시사한다는 점에서 중요한 의미를 가지고 있다” 고 말했다.

서인석 교수는 “신경세포 사멸의 상위조절인자의 발견으로 새로운 헌팅턴 질환 치료제 개발 가능성을 제시하고, 헌팅턴질환 병증의 이해는 그 외 알츠하이머병, 파킨슨병 등의 신경성 퇴행질환 병리에서도 TRPC 이온통로의 기능이 중요한 의미가 있을 것으로 생각하며, 치료에서도 효과가 있을 것으로 기대한다” 고 말했다.
이 연구 성과는 2015년 7월 1일(수) 온라인으로 옥스퍼드대가 발행하는 Brain 저널에 발표되었다. 서울대 의대 연구팀 홍찬식 박사와 한양대학교 서혜명 교수가 이 논문의 제1저자이고, 한국과학기술연구원(KIST)의 류훈 교수와 함께 서울의대 서인석 교수가 총괄책임자로 이 논문의 교신저자이다. 이 연구는 미래창조과학부의 한국연구재단과 BK21 플러스 사업의 지원을 받았다.
내용 요약
□ 헌팅턴질환의 병변인 대뇌 선조 신경세포의 산화적 스트레스와 칼슘 의존적 사멸 과정
o 신경성 퇴행질환인 헌팅턴은 유전질환으로 헌팅턴 유전자의 돌연변이가 그 원인임.
o 병리적 특징은 선조 신경세포의 선택적 파괴로 신경세포의 운동 및 특정 정신기능이 정지하는 질환임.
o 산화스트레스와 세포내 칼슘농도가 증가되나 원인과 상관관계에 대한 메카니즘 연구가 부족함.
o 세포내 칼슘항상성 조절 문제를 야기할 핵심 위험인자로 TRPC5 칼슘이온통로를 발견하였고, 산화스트레스에 의한 TRPC5 칼슘이온통로의 산화 손상이 이온통로의 기능을 항진함.
o 칼슘의 과도한 유입이 세포내 칼슘 신호전달을 교란시키고, 신경세포의 사멸유도를 촉진함으로써 선조 신경세포의 손실을 초래함.
o TRPC5 이온통로의 유전적 / 약물적 기능 억제로 정상 선조 신경세포의 손실을 감소시켰으며, 헌팅턴병의 병리학적 행동소견이 개선됨.
o 헌텅턴 질환자와 쥐 모델에서 TRPC5 칼슘이온통로의 산화 손상이 관찰되었으며, TRPC5 칼슘이온통로를 타겟으로 하는 저해제는 치료 및 예방적 측면으로 효과 가능성을 관찰.
o 성인 이후의 늦은 발병시기와 진행정도의 확인이 어려웠으나 TRPC 칼슘이온통로의 발현양상 변화를 통해 진단기법의 진전을 기대함.
o 헌팅턴병 이외에도 알츠하이머병, 파킨슨병 등 노화 관련 퇴행성 신경질환의 뇌신경 치료에 새 장이 열릴 것으로 기대함.
용 어 설 명
1. 헌팅턴병(Hungtington’s Disease)
염색체 4p16.3에 위치하는 헌팅턴(Huntington) 유전자에는 CAG 세 개의 염기가 반복되어 나타나는 특이한 서열이 존재한다. 헌팅턴병은 이 CAG 반복서열이 비정상적으로 증가되어 나타나는 질병으로 무도증, 정신증상 및 치매가 3대 증상이다. 병의 초기 단계에서는 무도증이 비교적 신체 일부에 국한되어 나타나지만 질환이 진행됨에 따라 무도증이 전신으로 퍼진다. 진단이 이루어진 후 사망에 이르기까지 15~20년 정도가 소요된다. 오랜 기간에 걸쳐 병이 진행되면 결국 과다근육긴장증과 심한 경직 상태에 이르게 되며 주로 흡인성 폐렴(음식물이나 입안의 미생물 등이 식도로 넘어가지 않고 기도로 잘못 흡인되어 발생하는 폐렴)으로 사망한다.
출처 : 서울대학교병원 의학정보
2. 산화스트레스
인체의 에너지 생성과정 중에 유해산소가 급격히 증가해 인체에 나쁜 영향을 일으키거나 그러한 상황을 이른다. 인체 내에서 발생하는 활성산소(유해산소)는 인체 내에서 적절한 위치와 시간, 적절한 양이 생성될 때 긍정적인 영향을 미치며, 또한 우리 신체의 방어기전 역시 유해산소에 의한 독성을 해소할 수 있다. 하지만 체내 활성산소가 많아져 생체 산화 균형이 무너진 상태를 의미하며, 체내에 지속적으로 축적되면 유전자나 단백질에 영향을 및거나 손상을 일으켜 다양한 질병을 유발한다.
3. TRPC 이온통로
초파리 변이체에서 처음 발견된 이온통로로, 빛에 의한 수용체 전압이 일시적으로 발생하는 것을 보고 TRP(transient receptor potential) 이온통로라 명명됐으며, 거의 모든 세포에서 세포내로 칼슘을 공급하는 단백질로 작용하여 감각기능, 혈압 조절, 세포의 사멸·분화· 증식 및 유전자 조절에 중요한 역할을 하고 있다. TRPC 이온통로는 그 중 한 유형으로, 지금까지는 주로 심장, 위장관, 혈관평활근 등 정상 생리학적 기능에 관여하는 것으로 알려졌지만 이번 연구를 통해 신경세포의 사멸과 같은 병태생리학적 기능에도 관여하는 것이 밝혀졌다.
그 림 설 명
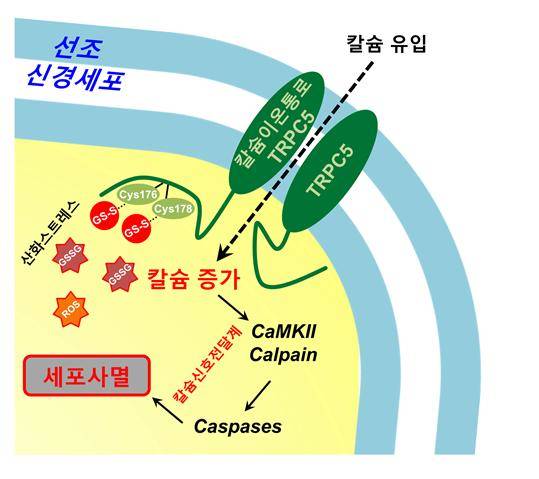
<선조 신경세포에서 TRPC5 칼슘이온통로의 산화 수식 과정>
선조 신경세포는 산화스트레스에 의해 높은 산화형 글루타치온(GSSG) 농도를 가진다. 신경세포에서 발현되는 TRPC5 칼슘이온통로는 GSSG에 의해 직접 산화 수식되어 이온통로의 활성이 증가된다. 세포밖 칼슘의 과도한 유입은 칼슘 의존적 세포사멸 신호전달이 초래되어 선조 신경세포의 손실이 헌팅턴병을 야기함.
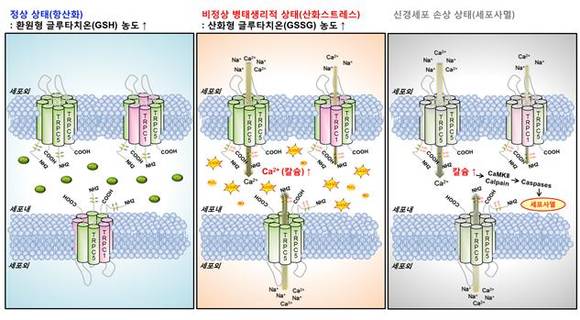
<헌팅턴병의 선조 신경세포에서 TRPC5 칼슘이온통로 의존적인 새로운 세포사멸 메카니즘>
정상 세포상태는 산화스트레스를 효과적으로 제거하여 항산화상태를 유지한다. 따라서 TRPC5 칼슘이온통로의 활성이 크지 않은 반면에, 과생산된 산화스트레스는 세포내 항산화물질인 환원형 글루타치온(GSH)를 산화형 글루타치온(GSSG)로 전환시킨다. 이렇게 증가된 산화형 글루타치온(GSSG)이 단백질을 산화 수식하며, 이때 선조 신경세포에서 발현되는 TRPC5 칼슘이온통로에 글루타치온화(S-glutathionylation) 산화 반응이 유도된다. 산화된 TRPC5 이온통로의 활성이 증가되어 칼슘이온이 유입되고, 세포내 칼슘농도의 증가는 세포사멸 신호전달을 야기한다.
