STAT3-mediated CD133 upregulation contributes to promotion of hepatocellular carcinoma
Cheolhee Won*, Byung-Hak Kim*, Eun Hee Yi, Kyung-Ju Choi, Eun-Kyung Kim, Jong-Min Jeong, Jae-Ho Lee, Ja-June Jang, Jung-Hwan Yoon, Won-Il Jeong, In-Chul Park, Tae-Woo Kim, Sun Sik Bae, Valentina M. Factor, Stephanie Ma, Snorri S. Thorgeirsson, Yun-Han Lee§, Sang-Kyu Ye§ (Hepatology, Accepted manuscript online: 6 JUL 2015, 2014 JCI impact factor 11.055)
간암은 만성적인 염증에 의하여 초래되며, 한국을 포함하여 세계적으로 흔하게 진단되고 높은 치사율을 가진 암이다. 초기에 발견하면 완치율이 높지만 자각증상이 거의 없어 조기 발견이 어렵고 진행된 상태에서는 치료가 어렵고 높은 재발율을 보이는 치명적인 질병이다. 따라서 간암을 조기에 진단하고 효과적인 치료방법을 개발하는 것은 간암 치료에서 중요하다.
CD133은 암줄기세포(cancer stem cell)로 알려져 있으며, 간암을 포함하여 다양한 종류의 암에서 발견되어 종양의 개시, 전이와 약물저항성과 관련이 있으며, 높은 재발율을 보여 암 치료를 어렵게 한다. 이전의 연구에서 CD133은 암줄기세포에 대한 기능에 대하여만 알려져 있을 뿐 발현과 관련된 분자기작은 아직까지 알려져 있지 않다.
STAT3는 전사인자로 작용하여 암세포의 성장과 증식에 필요한 다수의 유전자 발현을 유도하여 암의 발병, 유지 및 전이에 관여하는 것으로 알려져 있지만 아직까지 CD133와의 관련성에 대해서는 전혀 알려져 있지 않다.
본 연구는 간암 환자의 간조직에서 활성화된 STAT3와 HIF-1a 및 CD133의 발현이 증가되어 있으며, 간암 환자의 혈액에서 IL-6 농도가 증가되어 있다는 사실에 주목하여 이들의 상호관련성에 대하여 연구를 시작하게 되었다.
다수의 간암 세포주에서 STAT3의 활성화와 CD133 발현의 증가가 관찰되었으며, 모든 간암세포에서 IL-6에 대한 수용체 (IL-6R와 gp130)가 발현되고 있는 것을 확인하였다.
따라서 IL-6에 의하여 활성화된 STAT3가 CD133 발현에 중요한 역할을 할 것이라 추측하였고 세포를 이용하여 가설을 확인하였다.
실제로 간암세포에서 STAT3가 IL-6에 의하여 활성화되면 CD133의 전사활성과 발현이 증가되었으며, 이러한 현상은 AG-490 또는 sorafenib을 이용하거나 STAT3에 대한 shRNA를 이용하여 STAT3의 활성을 억제하면 CD133의 전사활성과 발현이 모두 감소하였다. CD133의 발현은 산소가 결핍된 저산소상태의 종양미세환경에서 HIF-1a의 발현에 의하여도 조절되었으며, 활성화된 STAT3와 HIF-1a 발현이 함께 존재하는 경우 CD133의 발현이 더욱 증가하였다.
저산소 종양미세환경에서 CD133 발현에 대한 분자기작에서 STAT3가 또 다른 종양유발 단백질인 NF-kB와 함께 작용하여 HIF-1a의 프로모터 부분에 결합하여 작용하며, 이러한 효과는 sorafenib으로 STAT3 활성을 억제하였을 때 나타났다. 또한 분자생물학적인 접근과 마이크로어레이 분석에서 CD133은 세포주기와 생존 및 세포분열과 관련된 유전자 (Cyclin A, Cyclin D, Bcl-2, Bcl-xL, survivin, TACC1, ACF7, CKAP5, SKAP2, CLASP1, CLASP2, TRIP-Br2, MAP4K4)의 발현을 조절하여 세포분열을 촉진시키고 세포의 생존율을 증가시키는데 관여한다는 것을 확인하였다.
간암 세포를 이용한 CD133 발현에 대한 STAT3의 작용은 간암을 유발한 동물모델 실험에서도 동일한 결과를 확인하였다. 따라서 종양미세환경에서 활성화되는 STAT3에 의하여 CD133의 발현이 직접적으로 조절되고 있다는 새로운 분자기작을 세포와 동물 실험을 이용하여 규명하였다.

예상규 교수는 “본 연구결과는 간암에서의 CD133 발현에 대한 분자기전을 처음으로 규명하게 되었으며, 특히 종양미세환경에서 STAT3가 CD133의 발현을 직접적으로 조절하는데 관여하고 있다는 사실을 확인하였다. 또한 저산소환경에서 종양유발 단백질인 STAT3, NF-kB와 HIF-1a가 함께 협력하여 CD133의 발현을 더욱 증가시키는데 관여하고 있다는 확인하였다. 그러므로 활성화된 STAT3를 표적으로 하는 물질을 개발하여 CD133의 발현을 억제하면 간암 뿐만 아니라 STAT3 활성과 CD133 발현이 높은 다른 종류의 암에 대하여 새로운 항암치료의 전략이 될 수 있는 가능성을 열었다” 라고 말했다.

또한 연구팀의 김병학 박사는 “STAT3가 다양한 종류의 암 환자와 암세포에서 비정상적으로 활성화되어 있음이 다수의 연구에서 보고되었으며, 따라서 암 발생 및 종양의 성장과 전이에 밀접하게 관련이 있는 것으로 알려져 있으므로 STAT3를 표적으로 하는 새로운 항암제 개발의 가능성을 제시하였다. 그리고 아직까지 STAT3를 표적으로 하는 항암제는 개발되지 않았으므로 STAT3를 선택적으로 표적으로 하는 후보물질을 발굴하고 더욱 나아가 임상적으로 적용할 수 있는 새로운 항암제를 개발하는 연구를 지속해 나갈 것이다” 라고 발표하였다.
본 연구성과는 2015년 7월 6일에 WILEY-BLACKWELL에서 발행하는 위장병학과 간장학 계열의 유명한 저널지인 Hepatology에 발표되었다. 서울의대 약리학교실 원철희 박사와 김병학 박사가 이 논문의 제1저자이고, 연세의대 방사선 종양학과 이윤한 교수와 서울의대 약리학교실의 예상규 교수가 이 논문의 공동교신저자이다. 이 연구는 보건복지가족부(암정복개발사업)와 미래창조과학부의 한국연구재단이 추진하는 기초연구사업(선도연구센터 및 중견연구자지원)의 지원으로 수행되었다.
연구결과 요약
간암 줄기세포 표지자 CD133의 발현이 종양미세환경 조건에서 STAT3에 의하여 조절됨
o 간암은 세계적으로 여섯 번째로 흔하게 진단되고 세 번째로 높은 치사율을 가진 암으로 우리나라에서는 남성 암 사망원인의 1~3위를 차지할 정도로 흔하고 무서운 암임.
o 간암은 주로 바이러스성 간염, 알코올성 또는 비알콜성 원인에 의하여 초래되는 만성염증과 밀접하게 관련되어 있음.
o 진행된 상태의 간암은 치료가 어렵고 치명적이지만 많이 진행되기 전까지는 자각증세가 거의 없어 조기 발견이 어려우므로 환자의 30~40%에서 조기진단에 의한 외과적 수술 및 간 이식과 같은 치료를 받는 실정임.
o CD133은 막전이성 당단백질로 간암을 비롯하여 다양한 종류의 암세포에서 발견되는 암줄기세포의 특성을 가지고 있음.
o CD133은 종양의 개시, 전이와 약물저항성과 관련이 있으며, 특히 간암 환자의 높은 종양 생성율과 낮은 생존율과 관련이 있음.
o CD133 발현이 높은 세포는 colony-forming, 세포성장율과 종양발생율이 높으며, 간암 환자에서는 CD133 발현이 낮은 환자보다 생존율이 낮고 높은 재발율을 보임.
o CD133 발현을 억제하는 분자기작이 규명되면 암 치료와 재발율을 감소시킬 수 있지만 현재까지는 암줄기세포의 표지자적인 역할로 종양형성에 관련되어 있다는 연구가 주로 수행되었으며, CD133의 발현과 관련된 연구는 거의 진행되지 않음.
o STAT3는 세포질에서 존재하며 암세포의 성장과 증식에 중요한 인자로 작용하여 암의 개시와 유지 및 전이에 중요한 작용을 하는 것으로 알려져 있음.
o 간암의 종양미세환경에서 암줄기 표지자 CD133의 발현은 IL-6에 의하여 활성화된 STAT3에 의하여 조절되며, 저산소상태에서 발현이 유도되는 HIF-1alpha (HIF-1a)도 함께 중요한 작용을 하고 있다는 것을 규명하였음.
o STAT3 활성을 선택적으로 억제하면 HIF-1a와 CD133의 발현을 억제하여 간암을 치료할 수 있는 가능성을 세포와 동물 모델에서 관찰하였음.
o 간암에서 IL-6에 의해 유도된 STAT3 활성을 억제하여 암줄기세포 표지자인 CD133 단백질의 발현을 억제하면 간암 뿐만 아니라 STAT3 활성과 CD133 발현이 모두 증가되어 있는 다른 종류의 암 치료에도 획기적인 치료방법이 될 것으로 기대함.
용 어 설 명
1. 게재저널 소개
○ Hepatology는 미국 간질환연구회가 1개월을 주기로 발행하는 간질환 분야의 최고권위의 저널지로 2014년 기준 영향력지수는 11.055이다.
2. STAT3 (Signal Transducer and Activator of Transription 3)
○ 세포질에 존재하는 단백질로 활성화되면 homo또는 hetero dimer를 이루어 핵내로 이동하는 전사인자로, 특히 종양 발생과 관련된 신호전달 경로를 유발하는데 관여한다. 대부분의 종양미세환경의 면역세포와 종양세포에서 활성화되어 있어 세포의 생존, 증식 및 성장과 관련된 유전자의 발현을 유도하며 면역회피 기전이 작동되어 암세포의 사멸을 억제하고 종양의 발병과 성장에 관여하여 종양에 대한 약물치료, 면역치료 및 방사선 치료를 어렵게 하므로 항암 치료에서 예후가 나쁜 것으로 작용한다. 따라서 항암제 및 방사선내성 항암치료에서 STAT3를 표적으로 하는 치료적 접근이 암의 재발 및 전이를 억제 할 수 있는 가능성이 높을 것으로 예상된다.
3. HIF-1a (Hypoxia-Inducible Factor-1alpha)
○ 저산소 상태에서 외부의 산소농도의 변화에 반응하기 위하여 유도되는 전사인자로 해당과정이나 혈관신생 등과 관련된 유전자의 발현을 유도함으로써 세포내의 항상성을 유지하는데 관여한다.
4. CD133
○ Prominin-1으로도 알려져 있는 막전이성 당단백질 (5-transmembrane glycoprotein)로 간암을 포함한 다양한 종양에서 발현되는 암줄기세포의 표지인자로 알려져 있다. CD133 발현이 높으면 종양의 개시와 전이 및 약물저항성을 증가시키며, 환자에서는 낮은 생존율과 높은 재발율을 보이는 것으로 알려져 있다. 하지만 아직까지 암줄기세포 표지자로만 알려져 있을 뿐 기능과 유전자발현에 대하여 거의 알려져 있지 않고 있다.
5. 암줄기세포 (Cancer Stem Cell)
○ 암세포로 자가복제 (self-renewal) 기능을 가져 적은 수의 세포로도 종양을 형성할 수 있는 기능이 있으며, 항암치료에 내성을 가져 암 치료를 어렵게 한다. 따라서 암치료에서 암줄기세포를 표적으로 하여 치료를 하면 암의 전이와 재발을 막을 수 있을 것으로 기대되어 최근 관심이 집중되고 있다. 또한 암 조직에서 줄기세포의 발현 여부를 확인함으로써 환자들의 예후를 예측하고 치료하는 방법을 결정하는데 중요한 역할을 하므로 치료 뿐만 아니라 진단에서도 중요한 역할을 한다.
6. 종양미세환경 (Tumor Microenvironment)
○ 종양 조직을 둘러싸고 있는 주변 환경으로 정상세포군, 세포외기질 및 세포생장조절인자와 사이토카인 등을 포함하는 체액으로 구성된 복합적인 상태이다. 종양미세환경은 산소와 영양상태가 부족하고 종양세포와 주변의 정상세포 및 면역세포들과의 상호 신호전달이 증가되어 있다. 특히 암세포는 주변 정상세포와의 상호 신호전달을 통한 후성유전적 변화에 의하여 암화 증대, 전이 및 주변 세포질로의 침윤과 전이가 조절된다.
그 림 설 명
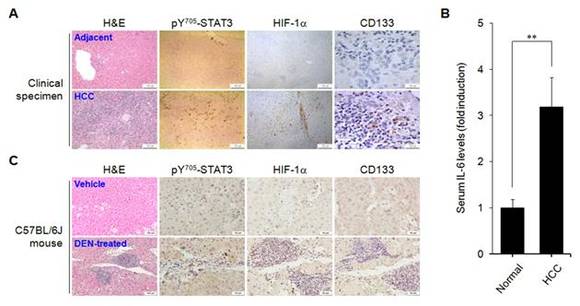
1. 간 종양조직 및 혈액에서 STAT3 활성 및 HIF-1a와 CD133 발현, 그리고 IL-6 농도가 증가되어 있음.
간암 환자의 종양조직과 DEN으로 간암을 유발한 마우스의 간 종양조직에서 활성화된 STAT3와 HIF-1a 및 CD133 발현이 증가되어 있다 (그림 A와 C). 그리고 정상인의 혈액과 비교하여 간암 환자의 혈액에서 IL-6의 농도가 증가되어 있다 (그림 B). 이러한 결과는 종양미세환경, 특히 저산소 상태의 종양조직에서 생성되는 IL-6에 의하여 활성화되는 STAT3와 발현되는 HIF-1a가 CD133의 발현에 중요한 역할을 할 것이라는 가능성을 시사한다.
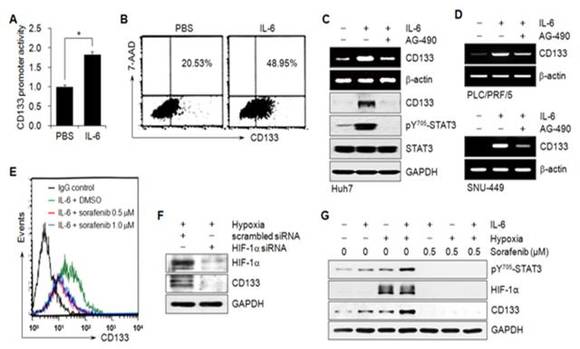
2. IL-6/STAT3와 HIF-1a에 의하여 CD133의 발현이 조절됨.
간암세포에서 CD133의 전사활성과 발현이 활성화된 STAT3와 HIF-1a에 의하여 조절되며 (그림 A-F), 활성화된 STAT3와 HIF-1a가 모두 존재하는 조건에서는 더욱 가속화되었다 (그림 G). AG-490 또는 sorafenib으로 STAT3 활성과 HIF-1a의 발현을 억제하면 CD133의 발현이 억제된다. 이러한 결과는 CD133의 발현이 저산소상태의 종양미세환경 조건에서 매개되는 IL-6/STAT3와 HIF-1a에 의하여 직접적으로 조절된다는 것을 의미한다.
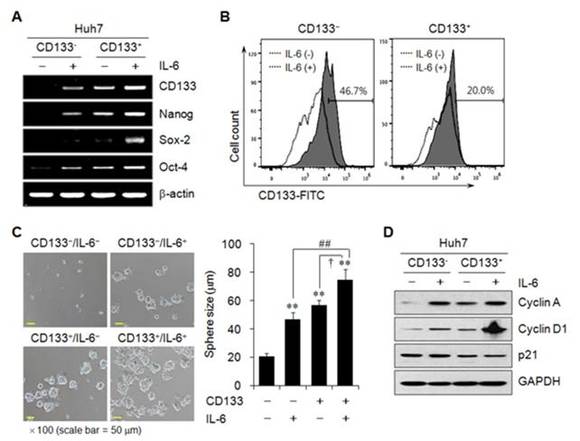
3. IL-6에 의하여 CD133 발현과 줄기세포 특성이 증가됨.
CD133의 발현과 암줄기세포의 특성이 IL-6에 의하여 증가하며, 이러한 발현 증가와 줄기세포 특성은 CD133-positive 세포보다는 CD133-negative의 세포에서 더욱 현저하였다 (그림 A-C). CD133의 작용에 대한 분자기전으로는 세포분열 촉진과 관련된 단백질의 발현은 증가시키고 세포분열 억제와 관련된 단백질의 발현은 감소시켰다 (그림 D). 이러한 결과는 CD133의 암줄기세포의 특성이 IL-6에 의하여 활성화된 STAT3에 의하여 조절되고 있으며, CD133 발현의 증가는 세포분열을 증가시켜 종양 발생의 가능성을 증가시키고 생성된 종양의 성장을 촉진하는데 관여한다는 것을 의미하는 것이다.
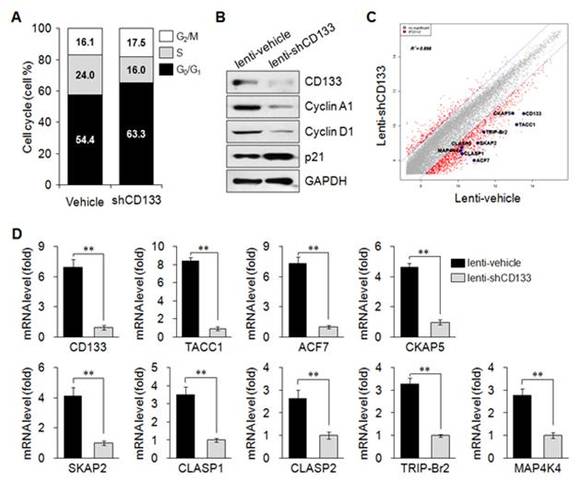
4. CD133이 세포주기와 세포분열을 조절함.
CD133 발현 억제는 세포분열 촉진과 관련된 단백질의 발현은 억제되고 세포분열 억제와 관련된 단백질의 발현은 증가시켜 종양세포의 세포분열이 억제되었다 (그림 A와 B). 마이크로어레이 분석에서 CD133은 세포분열 과정에서 중심체의 위치와 동원체에서 미세소관의 유동성을 조절하는데 관여하는 유전자의 발현을 조절하는 것이 확인되었다 (그림 C와 D). 이러한 사실은 CD133이 세포분열에 직접적으로 관여하며, 암미세환경에서 CD133 발현의 증가는 종양세포의 세포분열을 증가시켜 종양의 개시와 성장에 직접적으로 관여하고 있다는 것을 의미한다.
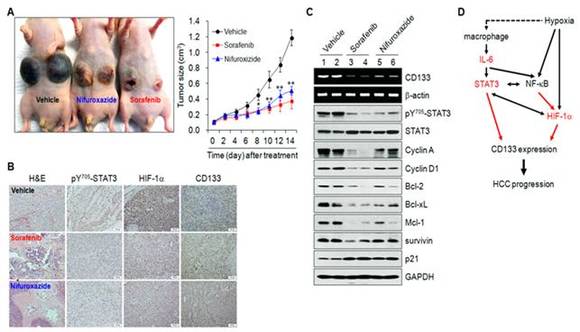
5. STAT3 활성 억제에 의한 CD133 발현 억제는 종양의 성장을 억제함.
종양미세환경에서 STAT3가 CD133의 발현을 직접적으로 조절한다는 결과를 동물모델에서 확인하기 위하여 CD133 발현이 높은 간암세포를 면역결핍 마우스에 주입하여 종양모델 (xenograft)을 만들었다. 종양이 형성된 마우스에 STAT3 활성을 억제하는 물질인 nifuroxazide 또는 sorafenib을 투여하여 종양의 크기를 측정하였다. 대조군에서는 종양의 크기가 현저하게 증가하였지만 STAT3 활성을 억제물질 투여에 의하여 종양의 크기가 현저하게 감소하였다 (그림 A). 면역화학적 염색과 분자생물학적 분석에서 nifuroxazide 또는 sorafenib는 활성화된 STAT3, 그리고 HIF-1a와 CD133 발현, 세포주기 및 세포성장과 관련된 단백질의 발현이 대조군과 비교하여 현저하게 감소되었다 (그림 B와 C). 이러한 결과는 종양미세환경에서 CD133의 발현이 활성화된 STAT3에 의하여 조절되며, 활성화된 STAT3를 억제하면 CD133에 의하여 유발되는 간암을 치료할 수 있다는 가능성을 나타낸다. 종양미세환경에서 STAT3에 의한 CD133 발현과 간암 유발 모식도 (D).
