정신신경계, 심혈관계 및 비뇨생식기계 의약품이 전체 69%차지
식품의약품안전처(처장 정승)는 ’14년 제네릭의약품 개발을 위한 생물학적동등성(이하 ‘생동성’)시험계획 승인 현황을 분석한 결과, 승인건수는 총 156건으로 ‘13년(163건)과 비슷한 수준이며, 제형 변경 등 새로운 패턴 의약품과 비뇨·생식기계의약품 개발 증가가 두드러지게 나타났다고 밝혔다.
이러한 ‘14년 제네릭의약품 개발 동향은 국내 제약사들의 연구 개발 분야 투자 확대, 세계적 인구 고령화 및 재심사·특허 만료 도래 등에 기인한 것으로 파악된다.
* 생물학적 동등성시험: 생물학적 동등성을 입증하기 위한 생체시험으로서 동일 주성분을 함유한 두 제제의 생체이용률이 통계학적으로 동등하다는 것을 보여주는 시험
식약처장은 ‘14년도에는 ▲오리지널의약품의 제형 변경 등 새로운 패턴 의약품 개발 ▲비뇨․생식기계의약품 증가와 심혈관계 및 소화계의약품 감소 ▲재심사 만료 및 특허 종료예정 의약품 개발 집중 등이 주요 특징이라고 밝혔다.
〈오리지널의약품의 제형 변경 등 새로운 패턴 생동성시험 승인 건수 증가>
새로운 제형(동일투여 경로) 개발 및 함량변경 등을 위한 생동성시험 승인 건수는 ‘13년(6건)에 비해 ’14년(28건)에는 4배이상 증가하였다.
이는 제약사가 기존의 단순 제네릭의약품에서 벗어나 제제 개선 등 다양한 제품을 개발하여 경쟁력을 확보하려는 시도로 볼 수 있다.
제형변경을 위한 승인이 20(71.4%)건으로 가장 많았으며, 이중 9건은 관절염 치료제인 ‘세레콕시브’를 캡슐에서 정제로 제형을 변경한 것이다.
〈치료영역 별로는 비뇨․생식기계 증가, 심혈관계 및 소화계 의약품 감소〉
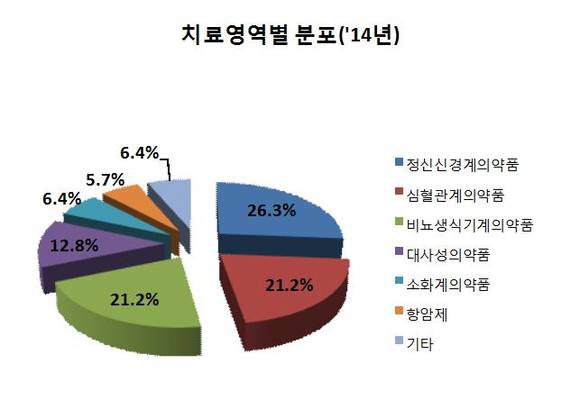
치료영역별 승인건수는 정신신경계의약품 41건(26.3%), 심혈관계의약품 33건(21.2%), 비뇨․생식기계의약품 33건(21.2%) 등의 순서로 많았다.
2014년 치료영역별 승인 현황
|
약효군 |
건수 |
백분율(%) |
|
정신신경계의약품(소염진통제, 우울장애, 간질치료제 등) |
41 |
26.3 |
|
심혈관계의약품(고혈압, 고지혈증치료제) |
33 |
21.2 |
|
비뇨생식기계의약품(발기부전치료제 등) |
33 |
21.2 |
|
대사성의약품(당뇨, 통풍치료제 등) |
20 |
12.8 |
|
소화계의약품(위·십이지장궤양치료제등) |
10 |
6.4 |
|
항암제 |
9 |
5.7 |
|
기타 |
10 |
6.4 |
|
총합계 |
156 |
100 |
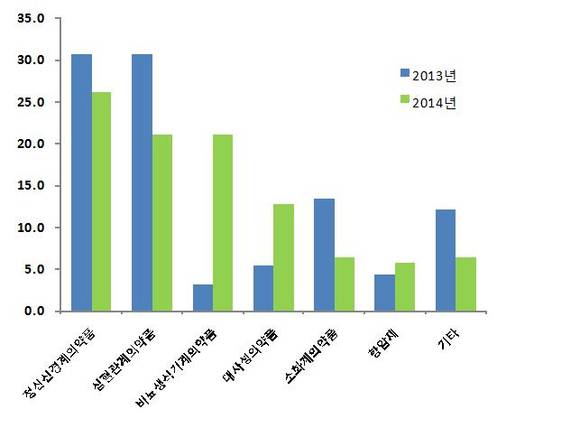
불안 및 우울장애, 관절염치료제 등 정신신경계의약품은 현대 사회 스트레스 증가 및 고령화 등의 영향으로 2011년 이후 처음으로 심혈관계의약품을 제치고 가장 많이 승인되었다.
고지혈증․고혈압치료제 등 심혈관계의약품은 지난해 33건이 승인되어 ‘13년(50건)에 비해 34% 감소하였고, 위·십이지장궤양 치료제 등 소화계의약품도 지난해 10건이 승인되어 ’13년(22건)에 비해 54% 감소하는 추세를 보였다.
특히 승인된 심혈관계의약품(33건) 중 18건(54.5%)이 복합제로 나타났으며, 이는 만성질환의 병용투여를 대신하여 복용방법 편의 등을 고려한 것으로 분석되고 있다.
또한 발기부전치료제 등 비뇨․생식기계의약품의 경우 제약사의 개발이 두드러졌는데, ’13년(5건)에 비해 33건으로 크게 증가하였으며, 이는 치료목적 이외에 삶의 질을 높이는 제품의 시장수요를 반영한 것으로 보인다.
〈재심사 만료 및 특허 종료 예정 의약품에 집중〉
‘14년도 승인된 156건 중 재심사 만료예정 또는 특허 종료예정인 오리지널품목에 대한 제네릭의약품 생동성시험승인은 68건(43.6%)을 차지하는 것으로 분석되었다.
|
순위 |
성분명 |
건수 |
적응증 |
|
1 |
타다라필 |
20 |
발기부전치료제 |
|
2 |
암로디핀베실산염/올메사르탄메독소밀 |
9 |
고혈압치료제 |
|
3 |
세레콕시브 |
8 |
관절염치료제 |
|
4 |
실로도신 |
6 |
전립선비대증에 수반하는 배뇨장애 |
|
5 |
둘록세틴염산염 |
5 |
우울장애 및 범불안치료제 |
|
시타글립틴인산염수화물/메트포르민염산염 |
5 |
제2형 당뇨병치료제 |
|
에스오메프라졸마그네슘 |
5 |
위·십이지장궤양치료제 |
|
8 |
게피티니브 |
4 |
비소세포폐암 치료제 |
|
로수바스타틴칼슘 |
4 |
고지혈증치료제 |
|
시타글립틴인산염수화물 |
4 |
제2형 당뇨병치료제 |
|
아토르바스타틴칼슘삼수화물 |
4 |
고지혈증치료제 |
|
암로디핀베실산염/텔미사르탄 |
4 |
고혈압치료제 |
|
13 |
도네페질염산염 |
3 |
치매치료제 |
|
라록시펜염산염 |
3 |
골다공증치료제 |
|
솔리페나신숙신산염 |
3 |
과민성방광 증상 치료제 |
|
아세트아미노펜/트라마돌염산염 |
3 |
소염진통제 |
|
쿠에티아핀푸마르산염 |
3 |
정신분열병 및 양극성장애치료제 |
|
페북소스타트 |
3 |
통풍치료제 |
|
19 |
두타스테리드 등 11성분 |
각 2 |
양성전립성비대증의 치료제 등 |
|
30 |
니코틴 등 38성분 |
각 1 |
금연의 보조요법제 등 |
|
합 계 |
156 |
성분별로는 ‘15년 9월에 특허 종료 예정인 발기부전치료제 ‘타다라필’이 20건으로 가장 많았고, ’14년 8월에 재심사가 종료된 고혈압치료제 ‘암로디핀베실산염/올메사르탄메독소밀’이 9건으로 두 번째였다.
이어 관절염치료제 ‘세레콕시브’는 8건(올해 6월 특허 종료), 배뇨장애치료제 ‘실로도신’ 6건(지난해 4월 재심사 종료) 등의 순이었다.
승인을 처음으로 받은 성분인 소염진통제 ‘아세트아미노펜/트라마돌염산염‘(14년 11월, 재심사 종료), 통풍치료제 ‘페북소스타트’(‘15년 6월, 재심사 종료), 항암제 ‘게피티니브’(‘16년 12월, 특허 종료)도 모두 재심사나 특허가 종료되었거나 예정인 품목이다.
* 재심사 : 신약의 허가 후 안전성·유효성 및 적정한 사용을 위해 필요한 정보를 수집하여 심사하는 제도. 재심사기간 동안 타제약사의 제네릭의약품 허가는 제한
식약처는 정신신경계의약품과 발기부전치료제 등 삶의 질을 높이는 제품 개발이 지속적으로 증가하는 경향이 있고, 단순 제네릭의약품에서 벗어나 새로운 제형(동일투여경로) 개발 등 새로운 패턴의 생동성시험이 향후 증가할 것으로 전망된다고 설명하였다.
생동성 승인 현황은 [온라인의약도서관
http://drug.mfds.go.kr → 의약전문가 → 생동성주간승인정보]에서 주단위로 확인할 수 있으며, 제약업계는 물론 누구나 제네릭의약품 개발동향을 신속히 확인할 수 있도록 생동성시험 승인현황을 지속적으로 제공할 예정이다.