[커넥트 클리니컬 사이언스, 문한림]
1) 악성종양의 뇌전이: 서론
악성 종양이 있는 환자에서 뇌전이는 매우 치명적인 합병증으로 그 자체가 중요한 사망원인이 된다. 뇌전이는 종양이 발생한 원발부위에서 뇌로 퍼지는 현상으로 성인 악성 종양 환자의 10-30%에서 발생하며 폐암, 유방암, 대장암, 신장암, 악성 흑색종에서 호발한다. 뇌로 전이된 종양은 크기가 자람에 따라 뇌압이 상승하거나 뇌의 정상적인 기능이 손상됨으로써 심한 두통, 어지러움증, 메스꺼움, 구토, 시력 장애, 기억 이상, 의식 저하, 간질 발작 등 여러 가지 증상을 일으킨다. 이 중 뇌압 상승은 매우 중대한 문제로 즉시 치료하지 않으면 생명을 위협하는 결과를 초래한다.
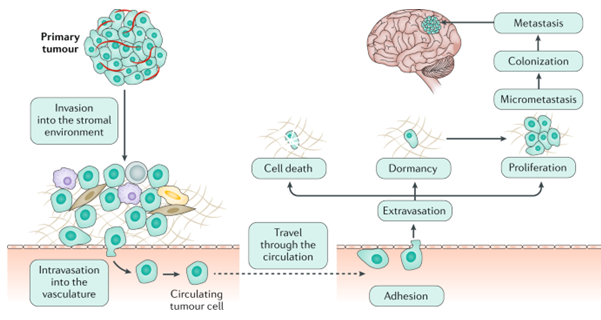
뇌전이는 원발 종양이 혈행성으로 퍼져 나가 뇌의 미세 혈관에 도달 후 종양이 성장하고 궁극적으로 뇌실질 조직 안으로 들어가 안착하여 종양 덩어리를 형성함으로써 일어난다. 뇌전이는 뇌의 grey matter와 white matter 사이에 일어나는 경향이 있다.
(Achrol AS, et al. Nature Rev Dis Primier 5:5, 2019)
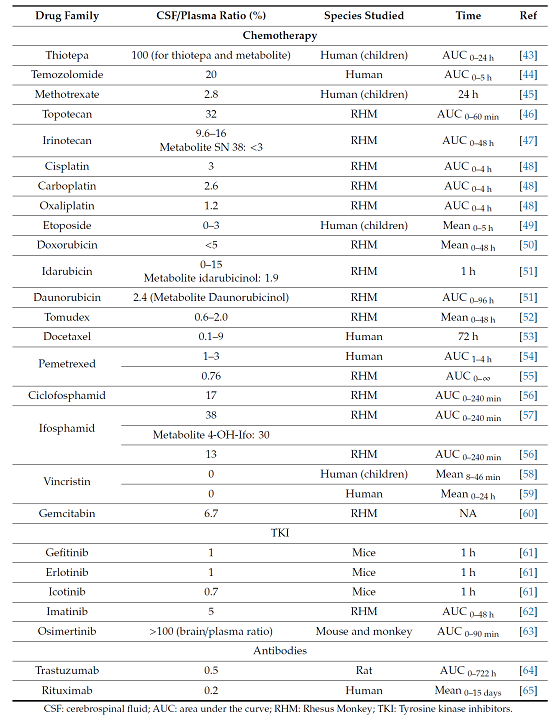
뇌는 태생학적으로 매우 중요한 장기이므로 뇌로 들어가려는 약물들에 대해 Blood-Brain Barrier (BBB) 와 Blood-CSF barrier 라는 장벽을 형성하여 뇌를 성역으로 보호하려는 성향이 있으며 이는 전신 항암제들이 뇌 안으로 전이된 종양에 대해 치료효과를 보이지 못하는 중요한 요인이 된다. 그럼에도 불구하고 암이 뇌에 전이되면 blood-tumor barrier 가 형성되어 약물에 대한 투과성이 BBB에 비해 높아진다. 그렇다고 하여도 일반적인 세포독성 항암제들은 혈액 내의 농도에 비해 CSF 내의 농도는 훨씬 낮은 농도로 존재한다. 표에서 보는 바와 같이 대부분의 세포 독성 항암제는 CSF/plasma ratio 가 매우 낮으며 temozolomide, topotecan, irinotecan, ifosfamide 정도가 10% 이상의 비율을 보인다. 이 표에서 주목할 만한 항암제가 osimertinib 으로 동물에서의 CSF/plasma ratio 가 100%가 넘는 것으로 보고되고 있고 이 데이터는 임상시험 및 임상에서 osimertinib 이 EGFR 변이가 있는 폐암 환자의 뇌전이에 대한 예방 및 치료에 매우 훌륭한 성적을 보임으로써 그 유용성을 증명하고 있다.
(Angeli E, et al. Int. J. Mol. Sci. 2020, 21, 22)
2) 뇌전이에 대한 치료 및 최신 발전
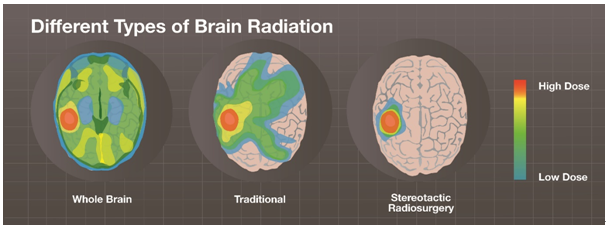
뇌전이에 대한 치료는 종양의 크기, 숫자, 전이 부위, 성장 속도에 따라 어떤 방법을 사용할지 결정하게 된다. 치료는 고식적으로 수술적 절제, stereotactic radiosurgery (SRS), whole brain radiation therapy (WBRT)를 사용하여 왔으나 종양의 숫자가 많거나 위치가 좋지 않은 경우 SRS 와 수술은 사용하기 힘든 방법이며, WBRT 는 부작용이 많아 제한이 있다. 아래 그림에서 보는 바와 같이 WBRT 는 표적 종양에 높은 선량을 쬐기는 하지만 뇌의 다른 부위에도 방사선량이 꽤 가기 때문에 정상 뇌조직의 손상이 많고 시간이 지날수록 중추신경계 기능 장애가 문제가 된다. 반면 SRS 는 전이 부위에 집중적으로 방사선량을 조사하여 정상 조직을 잘 보존할 수 있으나 전이가 여러 부위에 있는 경우 사용에 제한이 있다.
https://www.cancer.gov/publications/dictionaries/cancer-terms/def/wbrt
또한, 전술한 바와 같이 전신항암화학요법으로서 BBB 를 투과하는 약제는 매우 제한적이어서 치료 효과를 기대하기 어려워 잘 사용되지 않았다. 그러나 근자에 들어 osimertinib, alectinib. 그리고 BRAF와 MEK 저헤제들의 병용은 특정 유전자 변이가 있는 폐암 또는 악성흑색종의 뇌전이에 잘 듣는 결과를 보여 치료 패턴에 큰 변화를 가져왔다.
우선 alectinib 의 개발 경위와 뇌전이에 대한 효과를 보자. ALK 유전자 재배열이 있는 폐암의 치료에 개발된 최초의 표적항암제는 crizotinib 으로 3상 임상 시험에서 항암화학요법에 비해 우월한 치료 성적을 보였다. 그러나 치료 시작 당시 뇌전이가 없던 환자의 20%, 뇌전이가 애초에 있었던 환자의 70% 가 뇌로 전이되어 치료가 실패한 결과를 보여 주었다. Crizotinib 의 CNS/ plasma ratio 는 0.003 에 불과하여 뇌전이의 치료 또는 예방에는 역부족일 것이 매우 자명해 보인다. Crizotinib 에 이어 개발된 alectinib 의 개발 임상시험에서는 crizotinib 에 실패한 환자들이 등록되었으며 ALK 양성 뇌전이가 있었던 환자가 60%로 뇌 전이에 대한 반응율이 45%, 뇌 전이 질병 조절율이 83% 였다 (Ou SH, et al. J Clin Oncol 34:661-668, 2015). ALK 양성인 환자에서 1차요법으로서의 alectinib 과 crizotinib 을 비교한 3상 임상시험인 ALEX trial 에서는 alectinib 과 crizotinib 군의 mPFS 가 25.7 개월과 10.4 개월이었으며 뇌전이에 대한 위험율의 감소는 0.14 (HR 0.14) 로 괄목할 만한 우월성을 보어 주었다. (Peters S, et al. N Engl J Med 2017; 377:829-838). 동물 시험에서 alectinib 의 CSF/plasma ratio 는 0.63 to 0.94 로 crizotinib 에 비해 월등히 좋은 CNS 투과성을 보여 주고 있다. 다른 ALK 저해제인 lorlatinib, ceritinib, brigatinib 들도 뇌전이에 대해 좋은 항암 효과를 보여 주고 있다. 전이성 ALK 양성 폐암에서 뇌전이가 있는 경우 즉각적인 뇌전이 증상을 완화시키기 위해 SRS로 치료하는 경우가 아니라면 뇌전이에 대한 일차 요법으로 alectinib 을 사용할 것을 권고되고 있다. (Ernani V, et al. J Oncol Pract 15:563-570, 2019)
EGFR 의 유전자 변이가 있는 폐암에 gefitinib 과 erlotinib 이 오랫 동안 표준 치료로 사용되어 오다가 osimertinib 이 2015년 2차 치료제로, 2018년 1차 치료제로 승인받으면서 EGFR 양성 폐암 치료에 새로운 이정표를 그리게 되었다 (FDA). 이미 osimertinib 이 2차 약으로 개발될 당시부터 등록임상시험에서 뇌전이가 있는 환자들의 등록을 허용하여 약 40% 에 이르렀으나 AURA extension 과 AURA2 에서 뇌에 대한 반응율은 보고되지 않았다. 이후 AURA3 임상시험에서 뇌전이에 대한 반응율은 osimertinib 군 40%와 항암제 치료군 17%를 보여주었다 (Wu YL, et al. J Clin Oncol 36:2702-9, 2018).. 한편, 1차 치료제로 개발하기 위한 FLAURA 에서는 gefitinib 또는 erlotinib 대비 mPFS 가 18.9개월과 10.2 개월의 성적을 보였고 CNS 로 진행되는 경우가 20% 와 39% 로 osimertinib 군에서 훨씬 적은 뇌전이로 인한 질병 진행율을 보였고, 뇌전이에 대한 반응율은 66% 로 대조군의 43% 대비 높은 반응율을 보이는 것으로 보고되었다(Soria JC, et al. N Engl J Med 378:113-125, 2018). Osimertinib의 뇌조직 분포에 대해 생쥐를 대상으로 본 동물실험에서 혈장에서 보다 훨씬 높은 400% 의 농도를 보이는 것으로 보고하고 있다 (FDA Pharmacology review. Tagrisso. 2015). 그러므로 osimertinib 역시 태생적으로 뇌전이에 잘 듣는 약으로 개발되었음을 알 수 있다.
유전자 변이가 없는 폐암의 경우 면역항암요법제인 PD-1, PD-L1 항암제는 매우 좋은 효과를 보여 1차 또는 2차에 단일 또는 병용요법으로 승인받아 사용되고 있다. 개발 임상시험에서 뇌전이가 있고 증상이 있는 경우 임상시험에서 제외 되었으므로 많은 결과를 볼 수는 없으나 뇌전이가 있는 비소세포 폐암 환자에서 pembrolizumab 을 사용한 2상 임상시험의 결과는 33%의 반응율과 mPFS 7개월을 보여 앞으로 보다 많은 임상시험 결과를 기대하여 본다. (Goldberg S, et al. Lancet Oncol. 17: 976–983 2016)
악성 흑색종의 뇌전이에 dabrafenib 과 trametinib 의 병용요법은 44-56%의 반응율과 6개월의 mPFS 를 보여 주어 적어도 새로운 전신요법으로 사용할 수 있는 가능성을 보여 주었다. 그런데 뒤따라 보고된 nivolumab 과 ipilimumab 의 병용 결과는 55% 의 반응율과 6개월 PFS 가 67%를 보여 주어 지금 현재 가장 좋은 성적으로 받아들여 지고 있다. 표적항암제의 병용인 encorfenib 과 binimetinib regimen 의 뇌전이에 대한 효과를 보는 POLORIS 임상시험이 진행되고 있으므로 결과를 기다려 볼 일이다.
뇌지주막 전이는 뇌 전이 중 특별한 형태의 전이로 매우 치명적인 상태를 유발한다. 진단과 동시에 즉시 치료하지 않으면 급격히 진행하여 사망에 이르게 되며 이런 특징으로 인해 임상시험에 등록되기에 장애가 있는 환자 군이다. EGFR 변이가 있는 폐암, ALK 양성의 폐암, 그리고 BRAF 변이가 있는 악성 흑색종의 뇌전이에서, osimertinib, alectinib, dabrafenib 은 충분히 수용가능한 임상적인 유효성을 보여주어 현재 임상에서 사용되고 있다. (Brastianos P. ASCO 2019)
3) 뇌전이가 있는 환자에 대한 임상개발
FDA 는 최근 2년간 임상시험에서 너무 인위적인 제외 선정 기준을 통해 현실에서 존재하는 수많은 암환자들의 치료 방법에 대한 연구가 편파적으로 제외되지 않으면서 보다 명확한 환자 선정을 하기 위해 여러가지 지침을 개발하였다. 이 중 뇌 전이 환자에 대한 선정기준에 대한 지침이 포함되어 있으며 그 골자는 다음과 같다. (Cancer Clinical Trial Eligibility Criteria: Brain Metastases. Final)
• 이미 치료를 받았거나 안정된 뇌 전이 환자
이런 환자들을 제외하기 위한 강한 이론적 배경이 없는 한 1, 2, 3 상 임상시험에 모두 선정기준에 넣는다.
용량설정을 위한 임상 시험, 그리고 탐색적 임상시험: 약물의 BBB 통과 여부가 제외 선정의 기준에 영향을 미쳐서는 안된다.
환자는 임상시험 등록 전 신경학적으로 안정되어야 하며, 임상시험 1주 전부터 투여 스테로이드의 용량이 최소여야 한다.
• 증상이 있는 뇌전이
무조건 제외해서는 안 된다.
중추 신경계 독성이 있는 경우 제외한다.
• 뇌지주막 전이
무조건 제외해서는 안 된다.
중추신경계 효과가 기대되는 경우 조기 임상에서부터 선정할 수 있다.
후기 임상시험: 선정하여야 한다.
표. 환자 선정에 대한 FDA guidance
4) 항암 신약의 임상개발에 있어 뇌 전이에 대한 고려
악성 종양의 뇌전이는 해가 갈수록 늘어나고 있다. 이는 좋은 치료제의 개발과 이의 임상적용에 의해 환자들의 생존 기간이 늘어나고 있고 치료 효과가 좋더라도 중추 신경계로 투과가 덜 되는 약일수록 뇌 전이는 늘어날 수 있다. 또한, 원래 뇌전이가 잘 일어나는 폐암, 악성 흑색종, 신장암 등의 암에 대한 치료가 발전됨에 따라 이들의 뇌전이가 늘고 있는 것도 이유가 된다.
새로운 항암제를 개발함에 있어 1. small molecule 의 경우 BBB 를 통과할 수 있는 구조에 대한 구상 2. 정상적이 상태에서 BBB 통과 유무에 대한 연구 3. 전이가 된 모델에서 BBB 통과에 대한 연구 4. 비임상 동물 실험에서 뇌전이에 대한 유효성 검증 5. 비임상 PK 및 ADME 에서 약물의 중추 신경계 분포 및 CSF 농도에 대한 연구 6. 비임상 중추신경계 독성 7. 임상시험에서 뇌 전이가 있는 환자들의 cohort 에 대한 계획 등이다. 또한 면역 항암제와 세포 치료제들은 비임상 동물 실험에서 정상적인 상태와 뇌전이 모델에서 중추 신경계로의 투과가 일어나는지 여부, tumor microenvironment 의 변화와 이로 인한 뇌전이에 대한 효과 및 중추신경계에 대한 독성 연구 등을 충분히 고려하여야 한다.
뇌전이에 대한 효과가 뚜렷한 항암제는 전신적인 효과 위에 훨씬 더 큰 임상적 가치를 부여할 수 있는 사항이므로 이에 대한 인지가 매우 중요하다.