Transforming growth factor-β (TGF-β) 신호 전달은 다양한 생물학적 과정에서 결정적인 역할을 하며 세포 성장 억제, 세포 사멸, 분화 및 상피-간충직 전이 (epithelial-mesenchymal transition; EMT)와 같은 다양한 기능을 수행한다. TGF-β 신호전달계는 엄격하게 조절되며 세포 항상성의 유지와 더불어 발생 및 기관 형성에 결정적인 역할을 한다. 따라서 TGF-β 신호 전달의 교란은 암, 섬유증 및 선천성 기형과 같은 생명을 위협하는 질환을 유발한다.
TGF-β는 암화과정의 초기단계에서는 암 억제활성을 나타내나, 암화과정의 후기에는 암성장을 촉진시키는 것으로 알려져 있다. TGF-β1은 대부분의 암 조직에서 다량으로 발현되며, TGF-β1의 발현이 높은 암환자의 경우 악성인 경우가 많고 예후 또한 좋지 않은 것으로 알려져 있다.
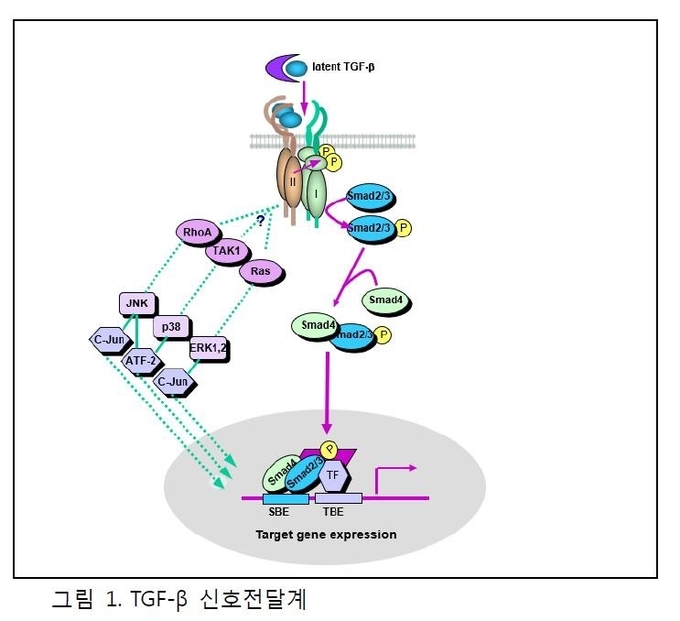
세포에서 분비된 TGF-β는 타입 I 및 타입 II 수용체로 구성된 두가지 타입의 수용체의 이종 복합체에 결합하여 신호전달을 개시한다 (그림 1). TGF-β는 II 형 수용체에 결합하게 되면 I 형 수용체는 이를 인식하여 II형 수용체에 결합을 하게 되는데 이때 II형 수용체가 I형 수용체의 GS부위를 인산화 시키게 되면 I 형 수용체 kinase가 활성화되게 된다. 인산화 된 TGF-β I 형 수용체는 Smad2 및 Smad3라는 TGF-β 신호전달 매개체의 C-말단 세린 잔기를 인산화시킴으로써 Smad2 및 Smad3의 활성화를 유발한다. 활성화된 Smad2 및 Smad3은 Smad4와 복합체를 형성하여 핵으로 이동하여 표적 유전자의 발현에 관여한다 (그림 1).
TGF-β 신호전달계의 양면성
TGF-β의 종양 억제 역할은 다양한 연구에서 입증되었다 (Connolly 및 Akhurst 2011). 유방암의 MMTV-TGF-β 유전자 조작 마우스 모델에서 유선 특이적 TGF-β의 과발현은 유방 종양 형성을 유의하게 억제하였고 (Pierce et al., 1995), 마우스 피부에서 TGF-β1의 과발현은 세포 성장을 억제하며 피부 유두종의 수를 증가시켰다 (Mao et al. 2006). 반대로, TGF-β는 암의 진행 단계에서 종양 성장, 침윤 및 전이를 촉진한다 (Korpal and Kang 2010; Massagué 2012). 이러한 상반되는 암진행과정에서의 TGF-β의 역할의 변화에 대한 상세한 분자 기전은 아직도 명확하게 규명이 되어있지 않지만, 종양 성장 억제에 관여하는 TGF-β 신호 전달계의 수용체나 Smad 유전자들의 돌연변이 혹은 종양미세환경에서 TGF-β의 역할 들이 부분적으로 이러한 변화를 설명할 수 있을 것으로 사려 된다. TGF-β는 종양세포나 다른 여러가지 세포 활성에서 epithelial-mesenchymal transition (EMT)를 조절하는 Ras-MAPK 나 PI3K-AKT를 포함해 수많은 SMAD 비의존적인 신호경로를 활성화하여 암화과정에서 다양한 활성을 나타낸다 (Padua and Massagué 2009, Massagué 2012, Wakefield and Hill 2013).
종양의 면역 환경 내에서 TGF-β의 역할
최근 면역항암제가 암치료에 새로운 전기를 마련함에 따라 면역세포에서의 TGF-β의 역할이 재조명되고 있다. 특히 종양의 면역 환경 내에서 TGF-β가 암의 성장 촉진에 중요한 역할을 하는 것으로 알려져 면역항암제와 다양한 TGF-β 신호전달 저해제의 병용치료가 큰 관심을 받고 있다. TGF-β는 면역계의 많은 구성 요소의 기능과 확장을 저해함으로 면역 항상성 (homeostasis) 과 관용 (tolerance)을 결정 짓는 중요한 집행자 역할을 하는 것으로 알려져 있다. 특히 종양미세환경에서 면역 억제의 중재자로서 TGF-β가 중요한 역할을 한다는 사실이 많은 연구를 통해 증명이 되었다.
TGF-β가 면역 내성과 염증 반응을 조절한다는 사실을 처음으로 생체내에서 증명한 것은 TGF-β1 유전자를 제거한 마우스 (TGF-β1 germline null 마우스)의 분석을 통해서였다. TGF-β1 유전자가 없는 마우스는 다양한 장기에 엄청난 염증이 발생하여 생후 3주내에 사망을 하게 되고 자가 면역 질환의 증상을 발견된다 (Kulkarni et al., 1993; Shull et al., 1992). 이때 모든 장기에서 MHC class II의 발현이 현저하게 증가하는 것으로 나타났다 (Letterio et al., 1996).
TGF-β 신호는 CD8+ T 세포의 세포 독성 프로그램을 직접적으로 억제한다. CD8+ 세포 용해 T 림프구 (CTL)는 종양 세포의 제거를 중재하는데 중요한 역할을 한다. 종양의 발달 및 진행은 TGF-β가 CD8+ CTL의 증식, 면역 감시 및 세포 용해 활성을 억제함으로서 촉진된다. 실제로, TGF-β1을 과발현시킨 마우스 생쥐 섬유 육종 세포의 경우 CTL에 의한 종양 거부가 억제되어 종양 성장이 촉진되었다 (Torre-Amione et al., 1990). 게다가 T 세포 특이적으로 비 기능성 TβR-II 돌연변이 체 (truncated TβR-II)를 발현하도록 하여 T 세포에서 특이적으로 TGF-β 신호 전달을 억제시킨 유전자 조작 마우스의 경우 흑색 종 성장과 전이를 근절시킬 수 있는 효과적인 면역 반응을 나타났다. 이와같은 연구 결과를 통해서도 TGF-β 신호가 종양내 면역에서 중요한 역할을 한다는 사실이 증명되었다 (Gorelik and Flavell, 2001). 또한 TGF-β를 CD8+ T 세포에 처리하면 암세포의 생존 신호를 활성화시키는 IL-17의 생산과 분비를 촉진시킨다 (Nam et al., 2008). TGF-β는 CD8+ T 세포와는 달리 CD4+ T 세포의 증식에는 영향을 주지 않지만 대신에 CD4+ T 세포의 분화를 억제하는 역할을 한다 (Gorelik and Flavell, 2001). 또한 TGF-β는 활성화된 CTL에 의한 과립 방출을 억제하는 Treg들의 선택과 확장을 유도하여 CTL의 종양 용해 활성을 불활성화시킨다 (López et al., 2006). CD8+ CTL과 유사하게, 자연 살해 세포 (NK)는 종양 세포를 표적화하여 종양 형성을 억제하는데 필수적인 역할을 한다. 암 세포를 죽이는 NK 세포의 능력은 NKp30 및 NKG2D 수용체의 활성화에 의존하며, 그의 발현은 NK 세포의 세포 용해 활성을 불 활성화시키는 수단으로서 TGF-β에 의해 쉽게 하향 조절된다 (Bellone et al., 1995; Moretta et al., 2000). 실제로, TGF-β 신호 전달의 전신적 감쇠는 정상 CTL 및 NK 세포의 종양 살상 활성을 증가되어 생체 내에서 면역계에 의해 종양 세포의 제거를 증가시키게 된다.
종양미세환경
종양 미세 환경에서는 암세포에서 생산된 과량의 TGF-β1은 암 세포의 신호전달계에 과도한 변화를 유발시킨다 (Picon et al., 1998; Calon et al. 2015). 이러한 변화는 암 세포와 종양-간질 상호 작용에 악 영향을 미치게 된다. 세포와 세포 사이의 cross-talk이 정상적으로 이뤄지지 않으면 permissive stroma (허용적인 간질)을 만들어 종양세포가 잘 퍼져갈 수 있는 환경을 만든다. 암세포에서 분비된 TGF-β는 EMT와 암 줄기 세포 (CSC)와 유사한 형질을 가진 세포로 암세포를 유도한다 (Peñuelas et al., 2009). EMT를 겪는 세포는 이동능력 (migratory ability)이 증가되어 전이를 일으키기 쉽게 되는데, 이들 세포는 방추형 모양 (spindle-shape)으로 변하고, 세포 골격에 변화를 일으켜 다른 장기로 이동이 쉽게 되어 전이가 용이하게 된다 (Scheel 2012). 상피 세포에서는 상피 세포 부착에 필요한 단백질인 E-cadherin의 소실 및 N-cadherin, vimentin 및 fibronectin과 같은 간엽 표지자의 발현 증가가 EMT과정에서 나타난다 (Scheel, 2012). TGF-β는 SNAI1/2, Twist 및 ZEB1/2 (Massagué 2012)를 비롯한 다양한 전사 조절인자를 활성화시키는 EMT의 진정한 매개체이다.
EMT (Scheel2012)를 겪는 종양 세포는 암줄기세포 (CSC) 성질을 획득하게 된다는 사실이 많은 연구에서 명백하게 되었다. 세포가 원발 종양 밖에서 종양형성하기 위해서는 암세포가 간엽 성질과 암세포를 유발할 수 있는 암 줄기세포 (CSC)로 발달을 하여 암세포가 운동성이 있어야 한다고 하는 “암 세포 가소성 가설”과 일치하는 결과이다 (Padua and Massagué 2009). TGF-β1에 노출된 대장암 세포는 노출되지 않은 세포에 비해 현저히 많은 종양구 (CSC의 전형적인 특징)를 형성하고 암줄기세포 마커인 CD44 과 SOX2의 발현이 증가되는데 TGF-β1 신호 차단제를 사용하면 이러한 효과가 억제된다는 사실을 통해서도 TGF-β1가 암 줄기세포의 형성에 중요한 역할을 한다는 사실이 증명되었다 (Zubeldia et al. 2013). 신경아 교종에서 TGF-β는 leukemia inhibitory factor (LIF)의 발현을 통해 신경 교종을 유발하는 줄기세포를 유도시킨다는 사실이 보고되었다 (Peñuelas et al., 2009).
TGF-β 신호를 타겟으로 하는 암 치료제 개발
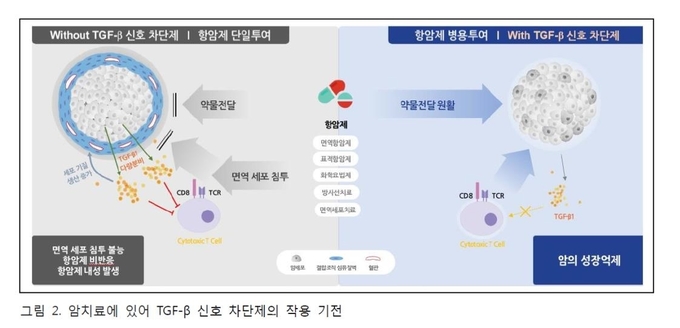
많은 전임상 데이터는 TGF-β가 종양 성장 및 전이를 예방하는 표적으로 간주될 수 있음을 보여주었다. TGF-β에 대한 단클론 항체, 저분자화합물 (kinase inhibitor), 안티센스 올리고 뉴클레오티드 (ASOs), 키메라 단백질을 포함하여 여러 가지 치료 옵션이 현재 임상에서 시험되고 있다 (그림 2).
TGF-β 신호억제에 기초한 치료법 개발은 생각보다 오랫동안 더디게 진행이 되어왔다. 그 이유는 TGF-β는 종양 억제인자라는 고정관념과 마우스에서 TGF-β 신호를 제거하면 심장의 발달에 문제를 가져오기 때문에 TGF-β 신호를 억제할 경우 심장 독성의 위험이 있을 것이라는 염려가 주된 이유였었다. 실제로 초기의 전임상 실험에서 TGF-β 신호 전달 차단제를 단독으로 사용한 경우 암의 전이는 억제하였으나 원발성 암의 성장은 억제하지 못하여 단독치료제로서의 개발은 진전이 되지 못했다. 그러나 지난 몇 년 동안, CD4+, CD8+ T 세포, NK 세포 또는 수지상 세포를 포함하는 특정 면역세포에서 TGF-β 신호 전달계에 관여하는 인자를 유전적으로 제거했을 때 전임상에서 강력한 항암반응이 유도된다는 사실이 증명되었다. 또한 말기 종양은 TGF-β1을 암세포의 조직 침투 및 전이에 이용한다는 압도적인 증거에 힘입어 다양한 TGF-β 신호 차단제가 개발되어 현재 임상 시험 중에 있다. 가장 광범위하게 시험 된 화합물은 Galunisertib (LY2157299)로 TGF-β 1형 수용체 키나제의 활동을 저해하는 작은 분자로 gemcitabine과 병용투여시 췌장암 임상 2상에서 어느 정도 치료 효과가 있는 것으로 나타났다 (Melisi et al., 2018). 그 외에도 뇌종양을 포함한 많은 임상이 진행이 되었는데 주목할 것은 Galunisertib의 다양한 임상 시험에서 심장 독성이 관찰되지 않았다는 것이다 (Kovacs et al., 2015). 체크 포인트 억제제와의 병용치료의 경우 전임상 연구에서 Galunisertib는 체크 포인트 억제제와의 병용치료의 효과가 월등한 반면, 단일 요법으로 TGF-β 신호 억제제는 제한된 효능을 보였다. 이는 TGF-β는 주로 암 미세환경을 조절하기 때문에 기존의 암치료제와 병용치료를 했을 경우에 암치료 효과를 극대화시킬 수 있다는 사실을 시사한다.
이러한 결과를 바탕으로 Galunisertib를 항 PD1 항체와 함께 시험하기위한 여러 임상 시험이 최근 시작되었다. 또한, Galunisertib보다 더 강력하고 특이적인 TGFBR1 저분자 억제제는 현재 개발 중이며 현재 환자에서 임상시험 중이다. 그 중 하나인 Vactosertib (TEW-7197)는 항암 화학 요법 또는 면역 항암제 [항 PD-1 항체 (키트루다; 펨브롤리주맙)
혹은 항 PD-L1 항체 (임핀지; 더발루맙)]와 함께 여러 암에 대한 임상 시험이 진행중이다. 전임상 연구에서 괄목할 항 종양 반응을 보여 이에 근거하여 임상 2상이 진행중이다. 1D11 항 -pan-TGF-β 항체의 경우 인간화 된 유도체 1D11 항체 인 Fresolimumab은 신장 세포 암, 흑색 종, 비소 세포 폐암 및 전이성 유방암의 치료제로 평가되고 있다. 보고 된 결과에 의하면 Fresolimumab은 전이성 유방암의 임상 시험에서 국소 방사선 치료와 병행 치료 했을 경우 환자의 전반적인 생존율을 증가시키는 것으로 알려져 있다 (Formenti et al., 2018). 이 효과는 CD8 + central memory cell pool의 증가와 연관이 있는 것으로 나타나 이 병용치료가 종양에 대한 면역반응을 촉발시켰다는 사실을 시사한다. 최근에 EMD Sereno가 GSK에 42억 달러에 기술 이전하여 화제가 되었던 EMD Sereno가 개발한 이중 특이 융합단백질 (bi-specific fusion protein)인 M7824는 항 PD-L1 항체와 TGF-β 2형 수용체의 세포외 부분을 융합한 융합 단백질로 다양한 암종에서 임상 2상이 진행중에 있다.
결론
TGF-β가 발견된 이래 TGF-β의 다양한 활성을 나타내는 기전과 생리학적 및 병리학적 상황에서 TGF-β 라는 다면 발현성인자 (pleiotropic factor)가 미치는 광범위한 역할을 증명하기 위해 많은 연구가 이루어졌다. 동물 모델 및 환자에서 수행된 많은 연구는 종양 발달을 손상시키는 TGF-β 신호전달계를 타깃으로 하는 항암제 개발의 잠재성에 기대감을 높이고 있다. 다중기능 성장인자 (Multifunctional growth factor)라는 특성 때문에 TGF-β을 타깃으로 하는 항암제의 개발은 더딘 면이 없지 않기는 하지만 최근 항암제 개발에 경향에 가장 적합한 항암제로 각광을 받을 날이 멀지 않았다고 생각한다. 최근에 개발된 TGF-β 반응유전자 (TGF-β response gene signature; TBRS)를 바이오마커로 환자를 선별하여 TGF-β 신호 차단제를 다양한 치료제와 병용 치료할 경우 부작용을 피하면서 치료효과를 높일 수 있어 cancer type (암형)에 관계없이 TBRS라는 유전자 바이오마커가 높은 환자를 선별하여 치료하는 치료제로 큰 관심을 끌게 될 것으로 기대된다
참고문헌
Bellone G.; Aste-Amezaga M.; Trinchieri G.; Rodeck U. Regulation of NK cell functions by TGF-β1. J. Immunol. 155:1066–1073; 1995.
Calon A, Espinet E, Palomo-Ponce S, Tauriello DV, Iglesias M, Céspedes MV, Sevillano M, Nadal C, Jung P, Zhang XH, Byrom D, Riera A, Rossell D, Mangues R, Massagué J, Sancho E, Batlle E (2012) Dependency of colorectal cancer on a TGF-β-driven program in stromal cells for metastasis initiation. Cancer Cell 22:571–584.
Connolly EC, Akhurst RJ (2011) The complexities of TGF-β action during mammary and squamous cell carcinogenesis. Curr Pharm Biotechnol 12:2138–2149
Formenti, S.C., Lee, P., Adams, S., Goldberg, J.D., Li, X., Xie, M.W., Ratikan, J.A., Felix, C., Hwang, L., Faull, K.F., et al. (2018). Focal Irradiation and Systemic TGFβ Blockade in Metastatic Breast Cancer. Clin. Cancer Res. 24, 2493–2504.
Gorelik L, Flavell RA. Immune-mediated eradication of tumors through the blockade of transforming growth factor-β signaling in T cells. Nat Med. 2001 Oct; 7(10):1118-22.
Korpal M, Kang Y (2010) Targeting the transforming growth factor-β signalling pathway in metastatic cancer. Eur J Cancer 46:1232– 1240.
Kovacs, R.J., Maldonado, G., Azaro, A., Ferna´ ndez, M.S., Romero, F.L., Sepulveda-Sa´ nchez, J.M., Corretti, M., Carducci, M., Dolan, M., Gueorguieva, I., et al. (2015). Cardiac Safety of TGF-β Receptor I Kinase Inhibitor LY2157299 Monohydrate in Cancer Patients in a First-in-Human Dose Study. Cardiovasc. Toxicol. 15, 309–323.
Kulkarni, A.B., Huh, C.G., Becker, D., Geiser, A., Lyght, M., Flanders, K.C., Roberts, A.B., Sporn, M.B., Ward, J.M., and Karlsson, S. (1993). Transforming growth factor β1 null mutation in mice causes excessive inflammatory response and early death. Proc. Natl. Acad. Sci. USA 90, 770–774.
Letterio, J.J., Geiser, A.G., Kulkarni, A.B., Dang, H., Kong, L., Nakabayashi, T., Mackall, C.L., Gress, R.E., and Roberts, A.B. (1996). Autoimmunity associated with TGF-β1-deficiency in mice is dependent on MHC class II antigen expression. J. Clin. Invest. 98, 2109–2119.
López M, Aguilera R, Pérez C, Mendoza-Naranjo A, Pereda C, Ramirez M, Ferrada C, Aguillón JC, Salazar-Onfray F. The role of regulatory T lymphocytes in the induced immune response mediated by biological vaccines. Immunobiology. 2006; 211(1-2):127-36.
Massagué J (2012) TGFβ signalling in context. Nat Rev Mol Cell Biol 13:616–630.
Nam JS, Terabe M, Kang MJ, Chae H, Voong N, Yang YA, Laurence A, Michalowska A, Mamura M, Lonning S, Berzofsky JA, Wakefield LM. Transforming growth factor β subverts the immune system into directly promoting tumor growth through interleukin-17. Cancer Res. 2008 May 15; 68(10):3915-23.
Mao J-H, Saunier EF, Koning JP de, McKinnon MM, Higgins MN, Nicklas K, Yang HT, Balmain A, Akhurst RJ (2006) Genetic variants of Tgfβ1 act as context-dependent modifiers of mouse skin tumor susceptibility. Proc Natl Acad Sci U S A 103:8125–8130.
Melisi, D., Garcia-Carbonero, R., Macarulla, T., Pezet, D., Deplanque, G., Fuchs, M., Trojan, J., Oettle, H., Kozloff, M., Cleverly, A., et al. (2018). Galunisertib plus gemcitabine vs. gemcitabine for first-line treatment of patients with unresectable pancreatic cancer. Br. J. Cancer 119, 1208–1214.
Moretta A.; Biassoni R.; Bottino C.; Mingari M. C.; Moretta L. Natural cytotoxicity receptors that trigger human NK-cell-mediated cytolysis. Immunol. Today 21:228–234; 2000.
Padua D, Massagué J (2009) Roles of TGFβ in metastasis. Cell Res 19: 89–102.
Peñuelas S, Anido J, Prieto-Sánchez RM, Folch G, Barba I, Cuartas I, García-Dorado D, Poca MA, Sahuquillo J, Baselga J, Seoane J (2009) TGF-beta increases glioma-initiating cell self-renewal through the induction of LIF in human glioblastoma. Cancer Cell 15:315–327.
Pierce DF, Gorska AE, Chytil A, Meise KS, Page DL, Coffey RJ Jr, Moses HL (1995) Mammary tumor suppression by transforming growth factor β1 transgene expression. Proc Natl Acad Sci U S A 92:4254–4258.
Picon A, Gold LI, Wang J, Cohen A, Friedman E (1998) A subset of metastatic human colon cancers expresses elevated levels of transforming growth factor β1. Cancer Epidemiol Biomarkers Prev 7:497–504.
Scheel CWR (2012) Cancer stem cells and epithelial-mesenchymal transition: concepts and molecular links. Semin Cancer Biol 22:396– 403.
Shull, M.M., Ormsby, I., Kier, A.B., Pawlowski, S., Diebold, R.J., Yin, M., Allen, R., Sidman, C., Proetzel, G., Calvin, D., et al. (1992). Targeted disruption of the mouse transforming growth factor-β1 gene results in multifocal inflammatory disease. Nature 359, 693–699.
Torre-Amione G, Beauchamp RD, Koeppen H, Park BH, Schreiber H, Moses HL, Rowley DA. A highly immunogenic tumor transfected with a murine transforming growth factor type β1 cDNA escapes immune surveillance. Proc Natl Acad Sci U S A. 1990 Feb; 87(4):1486-90.
Wakefield LM, Hill CS (2013) Beyond TGFβ: roles of other TGFβ superfamily members in cancer. Nat Rev Cancer 13:328–341.
Zubeldia IG, Bleau A-M, Redrado M, Serrano D, Agliano A, Gil-Puig C, Vidal-Vanaclocha F, Lecanda J, Calvo A (2013) Epithelial to mesenchymal transition and cancer stem cell phenotypes leading to liver metastasis are abrogated by the novel TGFβ1-targeting peptides P17 and P144. Exp Cell Res 319:12–22.