1. 머리말
현대 사회에서 암의 예방 및 치료가 더욱 중요해지고 있으며, 많은 제약회사와 기업들이 암 진단 키트 및 항암치료제 개발에 박차를 가하고 있다. 또한 다양한 종류의 암에서 종양발생, 암세포의 면역회피 등 세포 분자 수준에서의 연구가 활발히 진행되고 있다. 이에 따라 중요 기전에 관여하는 핵심 물질들이 발견되고 있고, 이들을 카겟으로 하는 새로운 암 치료법들이 개발되고 있다.
종양 미세환경에 존재하는 다양한 세포들은 종양발생에 도움을 주며, 특시 면역세포는 효과적인 항 종양 면역반응을 수행하지 못하게 하며, 역시 종양발생이 활발히 진행되도록 한다. STAT3((signal transducer and activator of transcription 3)는 많은 종양에서 과발현하고 있으며, 종양 미세 환경에서 종양세포 및 면역세포에서 지속적으로 활성화되어 있다고 보고되고 있다. STAT3는 종양 세포와 종양 미세환경 사이의 여러 가지 상호작용을 매개함으로써 암 발생에 도움을 주며 항종양 면역작용을 억제한다. 이에 따라 STAT3는 암 치료에서 성공 가능성이 매우 높은 단백질로 기대하고 있다. 본 기고문에서는 종양 미세환경에 대한 이해를 바탕으로 항암제 타깃으로서 STAT3 단백질의 기전과 기능을 알아봄으로써 의약품으로서 가치를 재고하고자 하며, STAT3 저해제의 개발 정보를 소개하고자 한다.
2. STAT3 단백질의 구조와 기능
STAT (Signal Transducer and Transcription) 단백질은 STAT1, STAT2, STAT 3, STAT4, STAT5A, STAT5B, STAT6의 subunit 형태를 가지는 전사인자로, 특히 STAT3는 인간 세포에서 여러 유전자의 전사에 관여하며, 정상적인 경우, 외부로부터 cytokines나 growth factors들에 의한 신호전달에 반응하여, 세포질에 존재 하고 있는 STAT3는 핵 안으로 이동하여 세포의 발달, 분화, 성장, 생존, 신생혈관합성 및 면역기능등을 위한 유전자들을 조절한다. 하지만 이러한 STAT3 단백질의 지속적인 활성화는 다양한 암의 원인이 될 뿐만 아니라, 각종 염증 질환 및 자가면역질환의 원인 단백질로도 알려져 있다. 많은 수의 악성 종양 환자 및 동물 모델 실험에서 지속적이고, 비정상적인 STAT3의 활성화가 관찰되었으며, 이러한 STAT3 과발현은 암을 유발하고 발전시키는 여러 다양한 유전자의 발현을 조절한다. 그러므로 STAT3는 암, 염증 및 면역 질환의 치료 타깃으로 연구가 진행되어 왔고, 최근에는 STAT3를 타킷으로 하여 억제효과를 나타내는 논문들이 보고되었다.
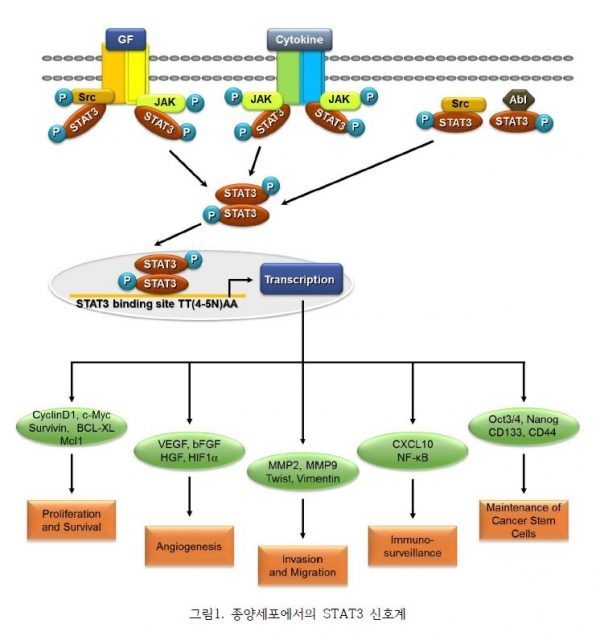
STAT3는 다양한 경로를 통하여 지속적으로 활성화됨으로써 종양 형성을 촉진한다. STAT3는 IL-6, IL-10, IL-21, IL-27 및 G-CSF 뿐만 아니라 receptor tyrosine kinase (EGFR, MET), non-receptor tyrosine kinase (Abl, Src, Syk) 등과 같은 발암 단백질에 대한 반응으로써 Tyrosine 705, Serine 727 의 잔기에 인산화를 통하여 활성화 된다. Tyrosine 인산화는 상호간의 인산화 Tyr-Sh2 도메인 상호관계를 통해 두 단위체 사이의 STAT3 이합체 형성을 촉진한다. 이러한 STAT3의 homodimer 또는 heterodimer의 형성은 유전자 발현을 조절하기 위해 필요한 DNA에 대한 결합력을 높여 핵 내로의 이동을 유도하게 된다. STAT3는 핵 속으로 이동하여 CyclinD1, c-myc과 같은 타깃 유전자의 promoter에 결합하여 암세포의 성장을 증가 시킨다. 또한 Bcl-XL, Mcl1 등의 조절을 통해 암세포의 사멸을 억제하며 VEGF과 같은 유전자의 발현으로 암세포에 유리한 신생혈관을 합성한다. 뿐만 아니라, 세포 이동 또는 침윤에 관여하는 유전자의 발현을 증가시킴으로써 암의 악성화에 기여한다. 흥미롭게도 STAT3는 면역억제물질의 발현을 유도하거나 pro-inflammatory mediator를 억제하여, 주변 미세환경에서의 면역 시스템을 저해하는 역할을 하고있다. 따라서 STAT3는 다양한 암에서 발견되는 단백질이며 STAT3 단백질의 활성화를 억제하면 STAT3에 의해 조절되는 다양한 유전자의 발현을 억제함으로써 암세포의 증식 및 전이를 저해하여 암세포 치료에 효과를 높일 수 있다. (그림1 참조)
3. 암세포 내 지속적인 STAT3 단백질의 활성과 조절
다양한 암 연구에서, 비정상적이고 지속적인 STAT3활성이 많이 확인되었다. 특히, 유방암, 두경부암의 상피세포암, 흑색종, 전립선암 및 뇌종양을 포함하는 종양 덩어리 및 다양한 골수종, 림프종, 백혈병과 같은 혈액 종양에서 관찰되었다. 이러한 연구는 비정상적인 STAT3활성이 일어나는 곳을 찾아서 저해하면 임상적 암치료제로서의 효과가 클 것이라는 것을 뒷받침한다. 현재까지 많은 연구들이 지속적인 STAT3신호계가 다양한 단계의 발암현상을 일으키는 중요 요소 일 것이라고 생각한다.
3.1 유방암과 지속적인 STAT3 단백질의 활성화
비정상적인 STAT3활성은 유방암모델에서 처음 발견 되었으며, 연구결과 유방암 발달 단계에 따라서 지속적 STAT3활서화 정도가 밀접한 상관관계가 있음을 보여주었고, 유방암의 진행 정도에 관여한다는 것을 밝혔다. 지속적인 STAT3의 활성은 유방암 세포의 성장과 증식을 촉진시킨다. 또한 항세포사멸 단백질을 조절함으로써 내성을 가지게 한다. 또한 많은 연구에서 EGF 수용체와 Src, Fak의 비정상적 STAT3 활성화가 유방암 내에서 연결되어 있다는 연구가 보고되었다.
3.2 두경부 상피세포암과 지속적인 STAT3 단백질의 활성화
두경부 상피세포암에서의 지속적인 STAT3활성화는 암의 진행 정도에 따라 일치 되었으며, 비정상적 STAT3활성을 저해하는 것은 암세포와 이종동물 모델에서 성장을 억제하고 세포사멸하는 것이 규명되었다. 이는 STAT3가 암세포 성장과 생존을 촉진하는 매개체였다고 할 수 있다. 두경부 상피세포암에서의 EGFR/Src의 활성이 지속적인 STAT3 활성을 유도하는 것으로 알려져 있다.
3.3 흑색종과 지속적인 STAT3 단백질의 활성화
유방암과 두경부 상피세포암에서 본 것 과 같이, 흑색종에서의 비정상적 STAT3활성은 세포 성장과 생존에 영향을 주는 유전자의 발현을 조절한다. 특히 동물 실험에서 지속적인 STAT3의 활성을 없애면 쥐의 흑색종양이 경감하며, 이는 악성 흑색종에서의 비정상적 STAT3 역할을 뒷받침한다.
3.4 전립선암에서의 지속적인 STAT3 단백질의 활성화
전립선 암의 발달에 STAT3의 활성이 영향을 미친다. 비정상적인 STAT3의 활성이 IL-6, IL-11과 밀접하게 연결되어있으며, JAK의 활성과도 밀접하게 연결되어 있다. 전립선암에서 비정상적인 STAT3 신호계와 JAK 활성의 연관성은 암세포에서 JAK에 의해 매개된 STAT3 저해가 암세포 성장을 막고 세포사멸을 유도하는 연구를 통해 보고 되었다.
3.5 뇌종양과 지속적인 STAT3 단백질의 활성화
지속직인 STAT3 활성화는 뇌종양 세포의 성장과 생존을 촉진하며, 암 진행에 영향을 미치는 것으로 보고 되어있다. STAT3를 억제하거나 JAK 활성을 저해하는 약리학적 저해제를 사용할 경우, 세포사멸을 유도할 수 있으며 뇌종양에서의 비정상적 STAT3활성은 항암화악요법에 내성을 가지게 하며, 신경교모세포종에서 약물 내성을 가지게 하는 것으로 보고 되었다. 또한 EGFR 돌연변이가 STAT3 활성을 가능케 하는 메커니즘으로 보고 되었다.
4. 종양미세환경에서 STAT3의 역할
종양 미세환경에 있는 면역세포들은 효과적인 항 종양 면역반응을 개시할 수 없을 뿐만 아니라, 종양형성을 촉진하기 위하여 변형된 세포들과 직접적으로 상호작용을 한다. 다수의 종양 발생 신호 결로에서 STAT3는 종양미세환경 내의 면역세포들과 종양세포 모두에서 활성화된다. 활성화된 STAT3는 종양 세포에 대항아는 면역 활성화에 필요한 중재자의 발현을 억제한다. 또한, STAT3의 활성은 유전자발현 프로그램을 변경하면서 다양한 면역 세포에서 STAT3를 활성화시키는 면역억제 요인의 생산을 촉진함으로써 항암면역반응을 억제한다. 엄밀히 말하면 STAST3는 종양에 의해 유도되는 면역억제 반응을 이끌며 종양세포와 그들의 면역학적 미세환경 사이에서 상호작용의 여러단계를 매개한다. 따라서, STAT3는 종양면역치료(immunotherapy)에 대한 유망한 표적으로 떠오르고 있다.
암의 특징은 종양 세포 증식과 생존, 종양의 혈관 신생 및 전이를 포함한다, 종양유전자(Proto-oncogenes)와 종양발생 신호경로의 활성은 종양세포내의 종양억제 유전자의 불활성화와 함께 악성변화(malignant transformation)과 진행(progression)에 중요한 경로이다. 동시에 종양 면역학자들은 외인성 종양억제가(extrinsic tumor suppressor)로서 작용하는 면역 감시체계 활성화를 위해 필요한 면역 위험 신호들의 결핍, 증가된 면역억제 인자의 농도 증가 그리고 종양 미세환경에 있는 면역억제 세포들의 축적은 면역 조절(immune regulation)은 암의 진행에 있어 주도적인 역항을 한다는 것을 의미한다. 종양 미세환경을 조절하는 특정 분자들과 신호전달 경로의 정의는 종양면역치료(cancer immunotherapy)를 위한 중요한 타깃을 제공할 것이다.
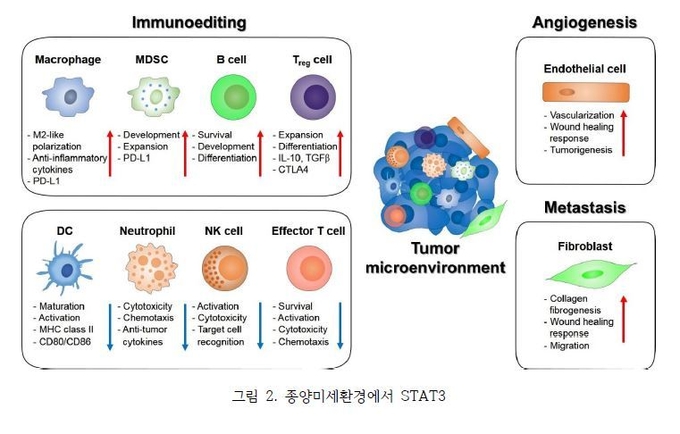
최근 연구들은 STAT3가 여러 단계에서 종양-유발 면역억제를 중재한다고 밝혀냈다. 또한 helper T cell 매개 염증 반응의 강력한 음성 조절자일 뿐만 아니라 면역억제에 요구되는 유전자들의 중요한 활성인자이다. 암세포내 STAT3의 활성화는 부분적으로 혈관내피성장인자 (VEGF)와 interleukin-10과 같은 STAT3-조절 인자들을 통해 선천성 면역과 적응면역 모두를 면역억제 하는 상호작용을 매개하고 있다. 또한, STAT3는 종양세포 증식과 생존, 종양의 혈관 생성과 침윤, 종양형성 (oncogenesis)과 면역억제사이의 직접적인 역할을 한다고 보고되고 있다. 대식세포에 STAT3가 과다하게 활성화되면 DC 성숙이 억제되며 CD80 및 CD86과 같은 공동 stimulatory 신호 및 IL-12, MHC 클래스 Ⅱ 복합체의 불충분한 발현을 유도하여 CD8+ T 세포를 활성화 할 수 없을 뿐만 아니라 그들은 또한 면역 tolerance를 유도 할 수 있다. 따라서 면역관용성의 DC는 효과적인 항원제시 세포가 되는 것이 차단되어 전체적인 면역감시능력이 떨어지게 된다. 또 다른 연구에서도 종양 세포 의존적인 STAT3의 활성에 의한 IL-10의 분비는 DC의 성숙을 억제하는 것으로 밝혀졌다. 그리고 종양 미세환경에서 중요한 면역억제능력이 있는 myeloid계 세포의 축적은 STAT3 활성화에 의한 것으로 잘 알려져 있다. 더불어 몇몇 최근 연구는 조절 T세포가 종양의 면역 환경을 유지하는데 중요한 역할을 하는 것으로 나타났다. T조절 세포들은 암환자들에게서 정상인에 비해 높은 비율로 종양 세포내에서 선택적으로 발견되며 mouse 종양 모델에서도 종양 전이의 말기 단계의 림프구의 대부분에서 발견된다. 이로 인한 면역감시체제의 붕괴가 이어지며 결국 암세포들이 마음대로 혈액을 통해 순환 되며 결국 전이를 일으켜 환자가 사망하게 되는 것이다.
그림 2에서 보듯이, STAT3 신호전달이 암세포와 암미세환경 사이의 정보전달에 도움을 준다고 알려져있다. STAT3는 내피세포 및 섬유아세포에 의한 면역 억제 효과 및 종양 촉진 효과를 유도하며 수지상세포에서 STAT3의 활성은 면역 관용을 촉진하는 성숙, 활성화, 항원제시를 억제한다. 또한 호중구, NK세포 및 효과 T세포에서의 STAT3 활성화는 면역 억제효과를 갖는다. 대식세포의 STAT3 신호전달은 M2-유사 분극을 선호하고 PD-L1 발현을 증가시키는 한편 STAT3 활성은 MDSC 집단을 증식 시킨다. STAT3는 B세포에서 생존, 증식, 발달을 촉진함으로써 CTLA4 발현과 종양 형성을 향상시켜 조절 T세포에서 면역 내성을 발휘한다. 내피세포에서 STAT3는 종양혈관화를 촉진한다. 종양 관련 섬유아세포에서 STAT3는 암 전이를 촉진한다. 종합적으로, STAT3 신호 전달은 암의 주요 조절자로 보고 되고 있다. 따라서, STAT3는 암세포뿐만 아니라 암세포의 미세환경에 있는 면역세포의 활성을 조절하는데 있어 새로운 암 치료의 발전에 대해 흥미로운 분자 표적이 된다. (그림 2)
5. STAT3 억제제
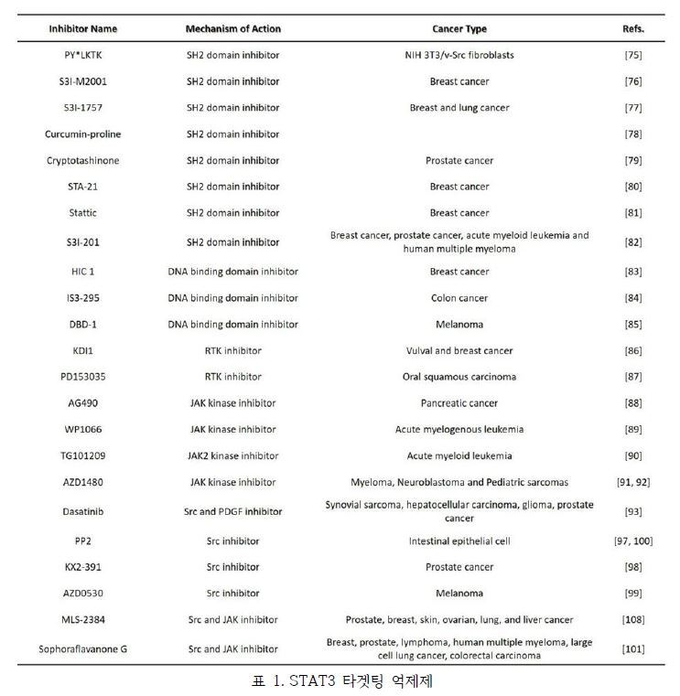
STAT3 억제제는 DNA 결합 도메인 (DBD) 억제제, SH2 도메인 억제제, STAT3 N-터미널 도메인 억제제로써 크게 세가지의 형태로 분류할 수 있다. DNA-결합 도메인 (DBD)의 작용은 STAT3의 전사활성 동안 요구된다. DBD는 반응을 보이는 유전자의 프로모터 부위의 DNA-결합 서열과 결합하고, DBD의 활성억제는 STAT3 의존 유전자 전사를 억제하며 이것의 종양촉진 기능을 방해한다.
STAT3의 SH2 도메인은 단백질 활성에 대한 수용체의 특정한 Tyrosine인산화 결합을 촉진하기 위해 중요하며, STAT3 단백질 사이의 dimer형성을 조절한다. 그러므로 SH2 도메인 억제제는 활성화된 STAT3의 dimer형성을 억제 시킴으로써 핵 내로의 이동을 막아 STAT3 신호전달 경로를 차단하는데 매우 좋은 접근 방법이다.
대략 130 아미노산으로 이뤄진 STAT3의 아미노-말단 도메인 (N-도메인)은 STAT3 의존적인 세포 반응을 제어하기 위해 사용될 수 있으며, 다른 전사인자 및 조절인자와의 상호작용을 통해 조절될 수 있다. 그러므로 적절하게 고안된 N-도메인 억제제는 항암 약물 표적으로써도 사용될 수 있다.
또한 STAT3 억제제는 다른 표적치료제와 조합하여 약물로서 유용할 것으로 기대되고 있다. STAT3는 많은 세포성장 과정에서 보조적인 신호전달을 맡고 있으므로 다른 신호전달과정의 억제제와 STAT3 억제제의 조합은 큰 시너지 효과를 기대할 수 있다. 교모세포종과 췌장암에서 STAT3와 EGFR의 억제제를 함께 사용하였을 때 암세포의 성장이 억제되고 STAT3의 활성이 낮아진다는 연구결과가 보고 되었다. 더 나아가, STAT3의 억제를 통해 화학요법적 항암제에 대한 암세포의 민감성이 증가되는 것으로 확인되었다. 그러므로 항암제 개발에서 STAT3는 단일 타깃으로도, 또한 다른 약물과의 조합적 처치의 타깃으로도 매우 흥미로운 주제이다. (표 1)
Cancer를 targeting하는 JAK 억제제의 연구는 1996년 AG490의 사용과 함께 시작되었다. 이때부터 많은 천연 생성물 (eg, 구르구민, 레스베라트롤, 플라보피리돌, 그리고 피세아타놀)이 임상전에 시험되었고 기본적으로 JAK의 직접적인 억제제로 cytokines의 감소를 통한 STAT3 인산화 억제를 포함한 염증과 관련된 무수히 많은 pathway의 억제가 증명되어 왔다. 게다가 JAK2 변이의 발견 이후 골수증식성 질환에서 더 강력하고 경구투여 가능한 JAK 억제자가 많은 제약회사들에 의해 개발되었다. 임상 전에 이러한 억제자들은 골수증식 모델에서 질병을 제거하는데 상당히 효과적이라고 보고되었다. 그 중 가장 훌륭한 연구는 단계3의 임상시도에서 JAK1/2 억제자 INCB018424이고, 염증 유발 cytokines 순환의 감소와 상호 관련이 있는 상당한 임상학적 발전 (부종, 염증, 불편, 식은땀 감소)이 보고되었다. 그러나 변이 JAK2 대립유전자에서는 단지 부분적인 감소만 관찰되었는데, 이것은 아마도 변이 JAK2 kinase의 불충분한 억제나 이 질병과 관련이 있는 다른 운반체 때문일 것으로 보고되었다. 또한, 혈소판감소증, 빈혈증, 백혈구감소증, G1 intolerance, 신경독성등의 반대효과를 가지고 있었지만, 비슷한 관찰이 다른 JAK 억제제 (CEP-701, XL019, TG101348)에서도 보여 졌다. 이런 JAK inhibitor들은 상반되는 효과를 나타내는 원인일 수도 있는 그들의 특이성 (JAK1/2 vs JAK2), 효능, 그리고 반감기가 제각기 다르기 때문으로 보고되었다. 중요하게도 JAK1/2는 보통 조혈작용에 필요하고, 그러므로 다양한 함유량 관리와 낮은 농도의 투여가 없으면 이러한 약은 빈혈과 혈소판 감소증을 일으킬 것이다. IL-6에 의한 유방, 난소, 전립선 암 모델에 암 성장 억제를 일으키는 JAK1/2 억제자 AZD1480의 사용을 통해 solid tumor에서 JAK억제 역할을 확인 할 수 있다. 이러한 합성물질들은 현재 solid tumor의 1단계 임상 시험에 사용되고 있다.
6. 맺음말
암발생과 전이에 STAT3 단백질은 기능에 대한 연구로써 과다하게 활성화되어 있으며 암신생혈관형성, 전이와 밀접한 관련이 있음이 규명되고 있다. 이외에도 STAT3는 암의 성장, 항-세포자살, 침윤, 종양미세환경에서의 항암제내성, 면역회피 등을 포함하여 종양의 개시, 발달, 진행에 중심적인 역할을 한다. 지속적인 STAT3의 활성은 넓은 범위에서의 인간 종양과 밀접한 관계가 있으며, STAT3는 종양을 예방하고 치료하기 위한 새로운 타깃으로 대두되었다. 몇 몇의 STAT3 억제제들은 이미 전임상 연구에서 항암효과를 보였고, 이제 임상 단계에서의 STAT3 억제제 개발이 시급하다. 특수적인 STAT3 억제제를 통하여 STAT3를 타깃하는 것은 임상적으로 종양을 치료하는데 매우 유용할 것으로 사료 되며, 이러한 항암제 시장은 환자의 삶의 질을 향상시키고 더 나아가 암 치료의 근본적 해결책을 제시 할 수 있다면, 무한한 가능성을 가진 시장이라고 볼 수 있다. 끝으로, STAT3 저해제도 이러한 가능성을 가진 약물로 개발 될 수 있기를 기대해 본다.
References
1.Huynh J, Chand A, Gough D and Ernst M (2019) Therapeutically exploiting STAT3 activity in cancer — using tissue repair as a road map. Nature Reviews Cancer
19, 82-96
2.Wang T, Niu G, Kortylewski M et al (2004) Regulation of the innate and adaptive immune responses by Stat-3 signaling in tumor cells. Nature Medicine 10, 48-54
3.Geiger JL, Grandis JR and Bauman JE (2016) The STAT3 pathway as a therapeutic target in head and neck cancer: Barriers and innovations. Oral Oncology 56, 84- 92
4.Hua Yu, Marcin Kortylewski and Drew Pardoll, Crosstalk between cancer and immune cells: role of STAT3 in the tumour microenvironment, NATURE REVIEWS | IMMUNOLOGY, JANUARY 2007
5.Lee H, Jeong AJ, Ye SK. Highlighted STAT3 as a potential drug target for cancer therapy. BMB Rep. 2019;52(7):415–423. doi:10.5483/BMBRep.2019.52.7.152