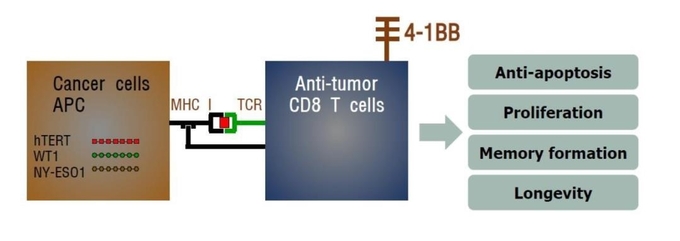
면역치료
면역 치료란 우리 몸의 면역 기능을 항진(enhance), 억제(suppress) 또는 조정(modify)하여 질병 치료에 응용하는 모든 방법을 일컫는다. 현재는 종양, 자가면역 질환, 이식 거부 그리고 만성 감염 질환 치료에 응용되고 있다. 자기 자신의 면역 기능을 이용함으로써 기존 항암제에 비하여 상대적으로 독성이 낮고 적응증의 제약이 적으며 면역 기능의 기본 성격인 면역 기억과 감시 기능을 획득할 수 있다는 장점을 가진다.
항암 면역 치료의 시작은 1891년 William Coley의 실험으로 거슬러 올라간다. 그는 bacterial culture를 sarcoma 환자에 주입하여 치료하려는 immune-modulating therapy를 인류 최초로 시도하였으며 이후 면역학의 발전과 함께 면역 치료제 및 치료 방법의 개발도 끊임없이 개선되어 왔다.
동물 실험에 의하면 T 세포는 체내 항암 효과의 약 80%를 담당하며 그 외는 NK 또는 NKT 세포가 담당한다. 즉 현재 가장 강력한 항암 효과는 T 세포를 이용함으로써 얻을 수 있다.
T 세포는 대부분 혈액 내에 비활성 상태로 존재하고 있으나 항원 자극을 받으면 활성 형태로 변하여 특정 항원을 가진 세포를 제거하게 된다. 암세포를 비롯한 변이된 세포의 세포사를 유도하는 세포 독성 T 세포 (CTL)는 세포 내에 과립을 다수 함유하고 있고 이들 과립은 암세포의 자살을 유도하는 perforin, granzyme 등의 물질로 구성되어 있다. 세포 독성 T 세포가 적절히 활성화되고 암세포와 만나게 되면 이들 granule 물질들이 암세포로 이동하여 항암 효과를 가져오게 된다.
T 세포의 공동자극 신호와 면역관문
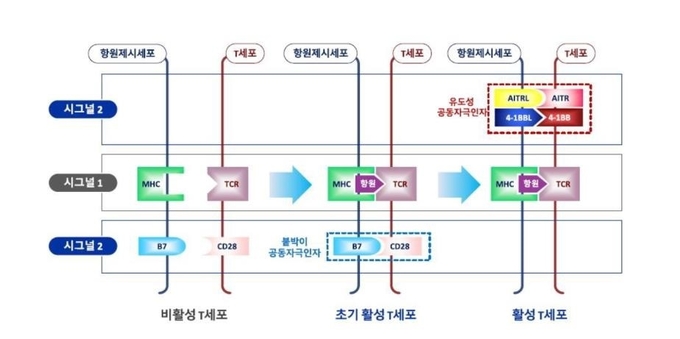
T 세포가 활성화되기 위해서는 두가지 신호가 전달되어야 하는데 이는 기본적으로 항원 특이 신호 (antigen-specific signal)와 공동자극 신호 (co-stimulatory signal)로 구성되며 공동자극 신호는 다시 붙박이(constitutive) 공동자극 신호와 유도성(inducible) 공동자극 신호로 나누어 진다(그림1).
그림1. T세포 활성화 기작
T 세포는 두가지 자극을 모두 받아야 활성화된다. 첫째는 항원의 신호이고 둘째는 공동자극 신호이다. 공동자극은 붙박이와 유도성 공동자극으로 나눌 수 있다. 붙박이 공동자극과 항원의 자극이 있으면 유도성 공동자극 인자가 발현된다. 현재 면역 치료제는 이들 유도성 공동자극 인자를 표적으로 개발되고 있다.
항원이 T 세포 수용체(TCR; T cell antigen receptor)에 결합하는 동시에 붙박이 공동자극 인자들(예: CD28, HVEM)이 관여하여 처음 2종의 신호를 생성하며 그 결과 활성화 중간 과정으로 유도성 공동자극 인자들(예: 4-1BB, AITR)이 T 세포 표면에 발현하게 된다. 이들 유도성 공동자극 인자의 신호가 T 세포에 전달됨으로써 T 세포의 활성화가 최종적으로 완성된다.
공동자극 인자들의 활성화를 위해서는 각 인자의 라이간드(또는 counter receptor) 결합이 필수적이다. 붙박이 공동자극 인자 CD28의 라이간드는 B7-1/B7-2/CTLA4, HVEM의 라이간드는 LIGHT/BTLA이다. 또한 4-1BB의 라이간드는 4-1BBL, AITRL은 AITR의 라이간드로 작용하며 공동자극 인자들의 활성화를 유도한다. 이들 라이간드는 항원 제시 세포나 암세포 모두에서 발현되고 있다.
체내에 외부 침입 병원체가 있거나 암이 발생하게 되면 이들 항원 침입 신호 정보는 항원 제시 세포 (수지상세포, 대식 세포 등)에 의해 림프절의 T cell zone에서 처음으로 T 세포에 전달된다.
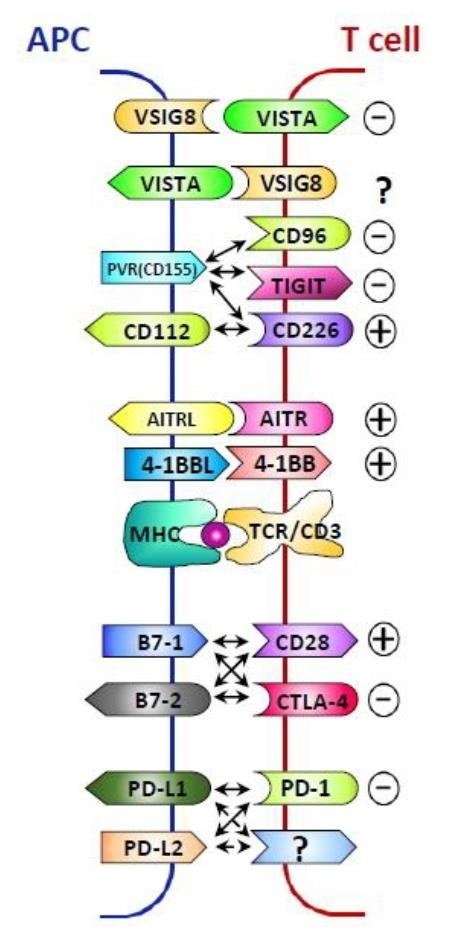
그림2. 면역관문 조절 수용체 및 라이간드
항원 제시 세포 (APC, antigen presenting cell)가 항원의 정보를 T 세포에 전달할 때 여러 종류의 수용체 및 라이간드의 상호 작용이 이루어지며 이들 신호는 T 세포의 활성과 억제 신호를 모두 포함한다. 면역관문 (immune checkpoint)은 억제 신호를 지칭하는 용어였지만 현재는 넓은 의미에서 APC와 T 세포가 만나는 부위를 의미하며 이들 활성 및 억제 신호를 함께 면역관문 조절 물질(immune checkpoint regulator)이라 일컫는다.
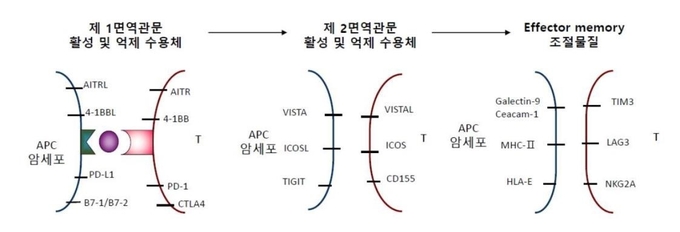
이때 항원의 정보를 제시함과 동시에 여러 종류의 붙박이 및 유도성 공동자극 인자들이 상호 정보를 교환하는데 (그림2) 이를 면역관문(immune check point)이라 부르기도 한다. 기존 면역관문은 억제 신호를 지칭하였기 때문에 면역관문 억제제란 이들 억제 신호를 차단함으로써 T 세포 활성화를 유도하는 치료제를 의미하였다. 그러나 지금은 넓은 의미에서 T 세포 억제 신호와 활성화 신호를 모두 면역관문 조절 물질(immune checkpoint regulators)이라 통칭하며 이들은 대부분 공동자극 수용체 및 라이간드들로 구성되어 있다. 최근 연구에 의하면 면역관문 조절 물질들은 순차적으로 반응하며 T 세포는 이들 면역관문 신호를 종합적으로 전달받음으로써 활성 반응의 정도를 조절할 수 있다. 면역관문은 다시 제1 면역관문과 제2 면역관문으로 나눌 수 있다. 한 예로 면역계가 PD-1/PDL-1의 차단에 의한 T 세포 활성화로 종양을 공격하면 암세포는 VISTA와 같은 제2의 면역관문 물질을 유도하여 이것이 다시 T 세포의 기능을 억제할 수 있다. 때문에 효과적 항암 효과를 얻기 위해서는 제2 면역관문인 VISTA의 역할도 억제해야 T 세포 활성이 그대로 유지될 수 있다 (그림3).
T 세포의 활성을 조절하는 수용체들은 면역관문 조절 물질 뿐만 아니라 T 세포 활성화와 분화 과정의 여러 단계에서 발현될 수 있다. 특히 T 세포가 effector memory 세포로 분화하고 최종 활성화되는 경우에 여러 종류의 억제 신호를 전달하는 수용체들이 다수 발현된다. 이들의 예가 Tim3, LAG-3, NKG2A 등이다. 이 외에도 다수의 AMIGO 계통의 물질들이 T 세포의 과반응을 억제하고 있다 (그림3).
이를 그림으로 설명하면 다음과 같다.
그림3. 단계별 T 세포 활성 조절
종양 세포는 제1 면역관문이 차단되면 제2 면역관문 물질을 발현하여 T 세포의 활성을 억제한다. T 세포 또한 분화의 마지막 단계에 이르면 여러가지 활성화 억제 물질을 발현한다.
항암 면역 치료제: 항체
현재 출시되어 있는 항체 치료제는 모두 면역관문 억제제이다. Anti-CTLA4 (여보이; Yervoy)와 anti-PD-1 (키트루다;Keytruda, 옵디보;Opdivo) 그리고 anti-PD-L1 (티센트릭; Tecentriq, 바벤시오; Bavencio)이 그것으로 이들의 특징은 강력한 항암 효과를 보이며 동시에 확장성이 크다는 장점을 가진다. 다시 말하면 적응증이 다양한 것이다. 옵디보가 8개의 적응증으로 허가를 받았고 키트루다 또한 7개의 적응증에 허가를 받았다. 지속적으로 다른 암 종에서 임상 시험을 수행하고 있으므로 적응증은 더욱 추가될 것으로 기대되고 있다. 항암 면역 치료제의 시장 전망은 2015년 약 19조원에서 2022년도에는 86조원까지 늘어날 전망이다. 또한 항암 면역 치료제는 그 개발들이 초기 단계이므로 이를 완성하기 위하여는 앞으로 약 10년은 더 필요로 하고 시장은 예상보다 더욱 크게 확장될 것으로 전망할 수 있다.
면역관문 활성제는 아직 출시되지 않았지만 개발은 억제제보다 더 앞서 시작되었다. 대표적으로 제1 면역관문 조절제에 속하는 anti-4-1BB, anti-AITR 및 anti-OX40 항체 등이 이에 속하며 전임상 시험 전 이들 활성제가 억제제보다 독성이 더 크리라고 예상하였지만 실제 전임상 시험 수행 결과를 분석하면 활성제가 독성이 훨씬 낮은 것을 알 수 있다. 또한 억제제는 T 세포를 억제하고 있는 신호를 차단하여 T 세포를 활성화시키는 치료제로서 T 세포의 다양한 사이토카인 분비를 유도하여 그 독성을 예측하기 힘들다는 단점이 있으나 활성제의 경우 본래 활성 신호의 경로가 이미 결정되어 있기 때문에 활성제를 처리한다 하여도 정하여진 활성 경로를 벗어나지 않으므로 T 세포의 활동이 예측 가능한 수준임을 알 수 있다.
항암 면역 치료제: T 세포 치료제
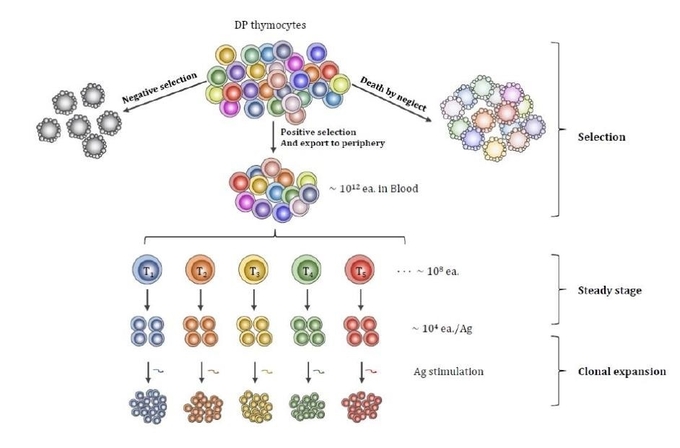
항암 면역 치료의 또 다른 종류는 세포 독성 T 세포 자체를 암퇴치를 위하여 사용하는 것이다. 여러 치료 방법이 개발되었으나 암항원 특이적 T 세포를 사용하는 T 세포 치료제는 크게 두가지로 미국 NCI (National Cancer Institute)의 종양 조직 내로 침투한 T 세포 (TIL;tumor-infiltrating lymphocytes)를 분리 배양하여 환자에게 재주입하는 방법과 한국의 유틸렉스에서 개발한 4-1BBCTL을 들 수 있다. TIL 치료제는 환자의 암 조직을 확보하여야 하고 이 암 조직 내에 침투된 T 세포가 존재하여야 한다. 또한 이들 T 세포 중 20% 정도만이 암세포에 반응하기 때문에 이를 다시 선별해야 하는 등 공정이 복잡하여 임상 적용에 어려움이 크다. 이에 반해 4-1BBCTL은 소량의 환자 정맥혈에서 암항원 특이적 T 세포를 4-1BB를 이용하여 순수 분리 배양하여 환자에게 재주입하는 방법이다. 4-1BBCTL은 항원 특이적으로 발현하는 4-1BB의 성질을 이용하여 소수로 존재하는 항원 특이적 T 세포를 분리한다. 체내에는 약 1012 개의 T 세포가 분포되어 있으며 이들은 약 108개의 항원에 반응하여야 하므로 각 항원당 약 104 종류의 T 세포로 구성되어 있다고 여겨진다. 때문에 1개의 항원에 반응하는 T 세포를 분리하기 위하여는 1억개 중 특이적인 1개 T 세포를 선별해야 한다(그림4).
그림4. T-cell receptor repertoire
T 세포는 특정 TCR을 발현하여 반응할 수 있는 항원이 결정되어 혈액으로 이동한다 (clonal selection theory). 암을 표적으로 하는 T 세포는 이미 결정되어 있고 이들 세포만이 특정암을 제거할 수 있는 능력을 가지고 있다.
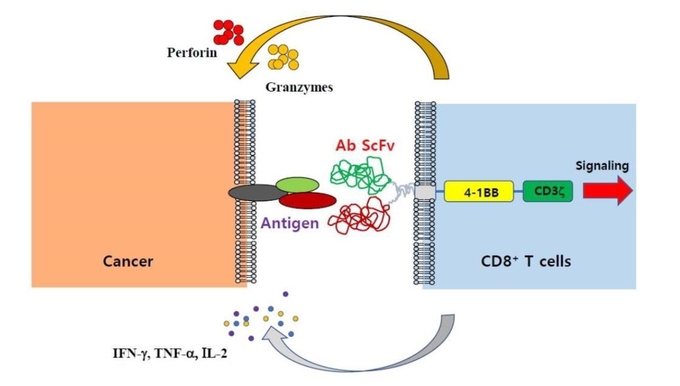
4-1BB는 T 세포가 특정 항원에 결합할 경우에만 세포 표면에 발현한다(그림5). 때문에 T 세포에 특정 암항원을 제시할 경우 이에 반응하는 T 세포만 4-1BB를 세포 표면에 발현함으로 이 세포를 4-1BB 항체로 선별하여 대량 생산하는 방법이 4-1BBCTL이다. 치료제로서 제작 공정이 간편하며 표준화가 가능하고 현재까지의 임상 시험에서 치료제 관련 독성이 전혀 관찰되지 않았다.
그림5. 4-1BBCTL 생성 및 분리
CD8 T 세포는 암 세포 외부에서 암 세포 내의 변화를 감지할 수 있다. 종양 세포는 세포 내 변이 단백질을 8-15개의 아미노산으로 구성된 펩타이드 형태로 MHC I 분자를 통하여 T 세포에 제시하기 때문이다. 이러한 기작에 의해 T 세포는 정상 세포가 암 세포로 전환된 상황을 감지하고 이를 제거할 수 있다. 이때 항원과 결합한 T세포는 반드시 4-1BB를 세포 표면에 발현한다. 4-1BB 발현 T세포를 항체에 의하여 간편히 분리하여 낼 수 있고 이들을 배양하면 고순도의 암항원 특이 T세포를 생산할 수 있다.
항암 면역 치료제: CAR T 세포 치료제
TCR T 세포 치료제의 연장으로 TCR 대신 암 표면의 암항원에 결합하는 항체를 응용하면 CAR (chimeric antigen receptor) T 세포 치료제의 개발이 가능하다. CAR T 치료제는 공동자극 인자의 신호 전달 도메인을 CAR module에 첨가하여 제작하고 (그림6) 이 수용체를 T 세포에 발현시킨 후 대량 증식하여 환자에 주입하는 방식을 취한다.
그림6. The mechanism of CAR-mediated tumor killing
CAR (Chimeric antigen receptor)는 T 세포 표면에 발현하여 암항원에 결합할 수 있는 항체와 TCR 신호와 공동자극 신호를 생성하는 세포내 부분으로 구성되어 있다. CAR가 암항원에 결합하면 암의 세포사를 유도하는 granzyme, perforin 등이 T 세포에서 분비되며 이들 인자에 의해 항암 효과가 나타나게 된다.
CAR T 치료제는 혈액암에서 대단히 높은 항암 효과를 보이지만 고형암에서는 그 치료 효과가 효율적이지 않다. 이는 고형암의 여러가지 특성상 CAR T가 효과적으로 암에 접근할 수 없기 때문으로 알려져 있다. 예를 들면 CD19을 발현하는 혈액암은 모든 암세포가 CD19을 균등히 발현하여 완치가 가능하지만 대부분의 고형암은 특정 표적 물질을 발현하지 않는 세포들이 존재하기 때문에 단일 표적만으로는 완치가 어렵다. 암의 미세 환경 또한 환자마다 독특하게 형성되어 있어 미세 환경의 조절 없이는 치료가 효과적이지 못하다. 고형암에 대한 암표적이 다수인 경우에도 표적 단백질을 발현하는 주요 장기에 작용함으로써 심각한 부작용을 유발할 수 있다. CAR T 치료제는 앞으로 이들 문제를 극복하여야 하며 고형암에서도 혈액암과 같은 치료 성적이 나오도록 개발되어야 할 것이다.
암에 대한 치료는 과학 기술의 진보와 지식의 확장에 따라 꾸준히 개선되어 왔다 그러나 여전히 암은 인류에게 넘어서야 할 큰 과제이다. 자가 면역계를 이용한 면역 항암 치료는 기존 치료제가 가지고 있던 여러 문제를 해결하면서 항암 치료의 최선으로 떠오르고 있다. 암환자의 생존율을 향상시켰을 뿐만 아니라 부작용을 획기적으로 줄였으며 적응증의 확장 또한 이루었다. 그러나 모든 암 종류의 완치에 이르기 위해서는 앞서 말한 예측이 어려운 면역계의 과다 활성화, 면역계에 존재하는 표적의 효율적 선정, 세포 치료제 생산의 표준화 그리고 선택적 항암 효과 등이 면역 항암 치료제 개발의 큰 도전이 될 것이다.