• 건선성 관절염 환자 최대 70%가 겪는 척추 부위 증상3 포함 전반적인 개선 효과 확인1
• 코센틱스 치료 2년간 10명 중 9명에서 방사선학적 진행 나타나지 않아2
• 전 세계 20만 명이 사용하는 코센틱스4, 이번 데이터 통해 척추관절염 및 건선성 관절염에서 빠르고 종합적이며 지속적인 치료효과 재확인 1, 2
노바티스는 자사의 인터루킨-17A 억제제 코센틱스®(성분명 세쿠키누맙)가 축성 증상을 가진 건선성 관절염 환자에 특화된 증상 개선 효과1를 입증하고 치료 2년차까지 방사선학적 진행 억제2를 확인한 두 건의 새로운 임상 데이터를 발표했다. 연구결과는 지난달 12일부터 15일까지 스페인 마드리드에서 열린 2019년 유럽류마티스학회(EULAR 2019) 연례학술대회에서 공개됐다.
이번에 발표된 두 건의 신규 데이터는 코센틱스가 건선성 관절염으로 인해 나타나는 주요 증상을 포괄적으로 관리하며, 새로운 표준 치료를 제시했다는 점에서 중요한 의미가 있다.
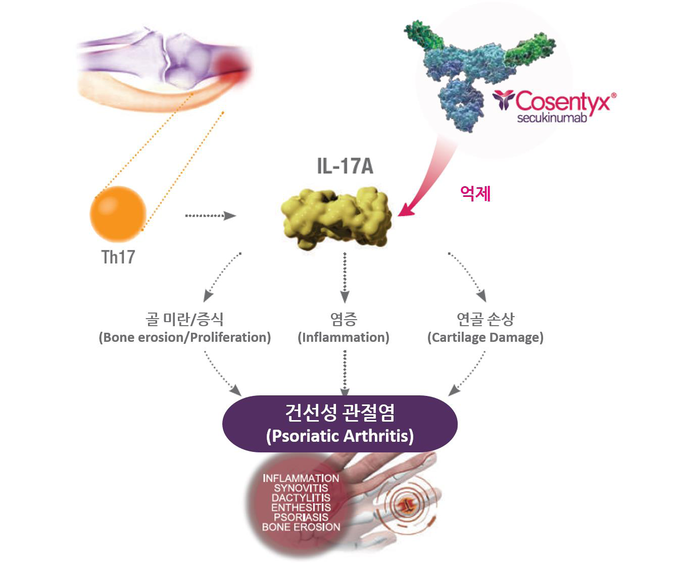
건선성 관절염 환자의 최대 2/3는 신체 활동을 제한할 수 있는 염증성 요통을 경험한다.3 이번 학술대회에서 발표된 코센틱스 관련 데이터는 축성 증상을 가진 건선성 관절염 환자들만을 대상으로 진행하여 축성 증상을 포함한 전반적인 개선 효과를 확인한 최초의 임상연구 결과다.1 해당 MAXIMISE 3b상 임상연구는 축성 징후와 증상이 나타난 총 498명의 건선성 관절염 환자를 대상으로 진행됐으며, 코센틱스 300mg 및 150mg 투여 환자의 각각 63.1%와 66.3%가 치료 12주차에 ASAS20에 도달해 1차 유효성 평가변수와 2차 주요 유효성 평가변수를 모두 충족시켰다.1 위약군의 도달 비율은 단 31.3%였다. 징후 및 증상의 호전은 빠르게 나타났으며 안전성 프로파일은 기존 임상연구와 유사하게 나타났다.1
코센틱스는 또한 FUTURE5 연구를 통해서 건선성 관절염에서 방사선학적 진행 억제 효과를 확인했다.2 연구를 통해 코센틱스 300mg를 투여 받은 건선성 관절염 환자의 89.5%에서 치료 2년간 방사선학적 진행이 나타나지 않았다(Baseline으로부터 0.5점 이하의 변화). 미국 류마티스학회의 질병활성도 평가 기준인 ACR 평가에서도 높은 임상 반응이 2년 간 유지됐다.2 코센틱스 300mg 치료 환자에서 104주차 ACR20/50 도달 비율은 각각 77%와 51.9%였다.2 이러한 결과는 최소 용량인 코센틱스 150mg 치료군에서도 나타났다.2 코센틱스 150mg으로 치료한 환자 가운데 82.3%는 2년 동안 방사선학적 진행이 관찰되지 않았으며, 104주차에 ACR20/50에 도달한 비율은 각각 79.4%, 52.6%였다.2
FUTURE5 임상연구의 참여 저자이자 스웨덴 병원 류마티스 연구소장 겸 시애틀 소재 워싱턴의과대 임상 교수인 필립 미즈 박사는 “건선성 관절염 환자의 절반은 약 2년내에 골 미란을 경험한다. 이를 방치할 경우 회복 불가능한 관절의 손상과 장애로 이어져 환자의 삶의 질에 심각한 영향을 줄 수 있다”면서 “이러한 측면에서 2년 내내 건선성 관절염의 방사선학적 진행 억제를 입증한 데이터가 발표된 것은 환자와 의료진 입장에서 매우 환영할만한 일이다”고 말했다.
더불어 한국노바티스 의학부 신소영 전무는 “이번 연구결과들은 코센틱스가 건선성 관절염에 대해서 보다 폭넓은 질환 관리의 혜택을 제공하고 있음을 나타내는 근거”라며 “앞으로도 코센틱스는 최초이자 유일한 완전 인간형 인터루킨-17A 억제제로써 척추관절염과 건선에 대한 온전한 치료를 찾는 환자들에게 새로운 표준 치료를 제시하고 환자들의 삶의 질 개선에 기여하기 위해 힘쓸 것”이라고 말했다.
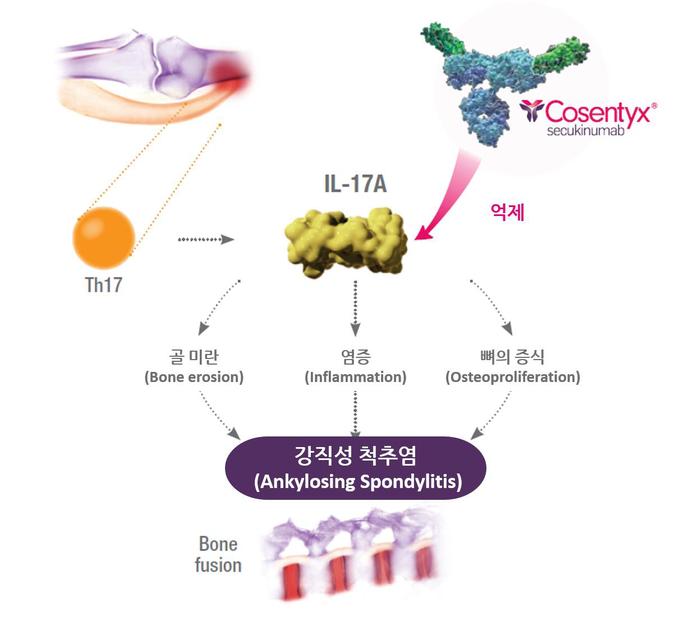
한편, 출시 후 지금까지 전 세계 20만여명 이상에 처방된 코센틱스4는 국내 건선과 건선성 관절염, 강직성 척추염에 허가를 받았으며, 3건의 5년 3상 연장 연구를 통해 모든 적응증에서 장기 효과와 안전성 프로파일을 확인한 바 있다.6-8
[참고자료]
MAXIMISE 연구에 대해1
MAXIMISE는 52주 동안 진행된 이중맹검, 무작위, 위약대조 3b상 임상연구로 건선성 관절염의 축성 증상 발현 관리에서 코센틱스의 효능과 안전성을 평가했다. 본 연구에는 임상의가 축성 징후 및 증상을 진단한 환자, 통증평가지수(VAS) 기준으로 척추 통증이 40/100 이상인 환자, 2개 이상의 비스테로이드성 소염진통제 치료에도 BASDAI가 4 이상인 환자를 포함에 총 498명이 등록됐다. 환자들은 첫 4주 동안은 주 1회씩, 이후에는 4주마다 1회씩 코센틱스 300mg 혹은 150mg을 피하투여 받았다. 1차 유효성 평가변수는 코센틱스 300mg 투여 12주차에 ASAS20 반응에 도달한 환자 비율로 정의했다. 주요 2차 유효성 평가변수는 코센틱스 300mg의 우월성을 확인한 후, 코센틱스 150mg 투여 12주차에 관찰한 ASAS20 반응으로 정의했다. 위약 투여 환자들은 12주차에 다시 무작위로 나뉜 뒤 코센틱스 300mg 혹은 150mg을 피하투여 받았다.1
ASAS20은 환자의 전반적인 평가, 통증평가, 기능(BASFI)과 염증 영역 중 3가지 이상에서 0~100을 척도로 20% 이상의 증상 개선과 10건 이상의 증상 개선이 있는 경우로 정의한다.10
* MAXIMISE 임상연구에 포함된 498명의 환자는 최소 2개 이상의 비스테로이드성 소염진통제(NSAIDs) 사용에도 불구하고 건선성 관절염(CASPAR 기준), 임상의 진단 기준 축성 증상, 척추 통증이 VAS>40/100이고 BASDAI>4인 환자이며, TNF-a 등 기존 생물학적 제제를 경험한 환자는 포함되지 않았다.1 반면, 국내에서 코센틱스는 기존 항류마티스제(DMARD) 치료에 대한 반응이 적절하지 않은 활동성 건선성 관절염을 가진 성인 환자의 치료에 허가 받았다.12
또한 MAXIMISE의 1, 2차 유효성 평가는 코센틱스 300mg 환자를 대상으로 실시했다.1 그러나 코센틱스 국내 허가사항에 따르면, 이 약의 권장용량은 1회 150mg으로 0, 1, 2, 3 및 4주째에 피하 투여하고 이후 한 달에 한 번 피하 투여한다.12 항-TNFa 치료에 대한 반응이 적절하지 않거나 중등도에서 중증의 판상 건선을 동반한 환자에서 이 약의 권장용량은 1회 300mg으로 0, 1, 2, 3 및 4주째에 피하 투여하고 이후 한 달에 한 번 피하 투여한다.12
FUTURE5 연구에 대해2
FUTURE5는 무작위, 이중맹검, 위약대조 3상 임상연구로 건선성 관절염 환자를 대상으로 2년 간 방사선학적 척추 변형에 대한 코센틱스의 효과를 평가했다. 해당 연구에서는 총 996명의 성인 활동성 건선성 환자들을 무작위로 구분하여 각각 300mg(부하용량 300mg), 150mg(부하용량 150mg), 부하용량이 없는 150mg 또는 위약을 0주, 1주, 2주, 3주, 4주차와 이후 매 4주째마다 피하투여했다. 환자들은 52주차부터 의사의 판단에 따라, 코센틱스 투여 용량을 150mg에서 300mg으로 증량할 수 있었다. 1차 유효성 평가변수는 16주차의 ACR20으로 정의했다. 방사선학적 척추변형은 24주차 mTSS 변화 평균치로 측정했으며, 주요 2차 유효성 평가변수는 손•발•손목에 나타난 골미란과 관절협착에 대한 X-ray 결과로 정의했다. 기타 평가변수로는 손•발가락 염증과 골부착부위 염증에 대한 ACR50, PASI75/90/100 반응 및 관해 등이었다.
코센틱스(성분명: 세쿠키누맙)
코센틱스는 건선, 건선성 관절염, 강직성 척추염에서 염증 및 질환의 진행에 관여하는 IL-17A 사이토카인을 직접적으로 억제하는 최초이자 유일한 인간 단일클론 항체의 생물학적 제제다.10
코센틱스는 손•발톱, 두피, 손•발바닥 건선은 물론 건선성 관절염과 강직성 척추염의 지속적인 증상 발현에 대한 전문 연구 등을 통해 강력한 임상 근거를 확보하고 있다.6-7, 11 코센틱스는 건선성 질환 치료에서 장기 효과와 긍정적인 안전성 프로파일을 입증해 완전한 치료 기회를 제공한다.7 코센틱스는 건선, 건선성 관절염, 강직성 척추염 환자들을 대상으로 한 3건의 5년 3상 임상연구에서도 지속적인 안전성과 장기적인 효과를 입증했다.6-8 코센틱스 출시 이후 현재까지 전 세계 20만여 명이 코센틱스로 치료 받았다.4
노바티스에 대하여
노바티스는 새로운 접근 방식으로 인류의 생명을 연장하고 삶의 질을 증진시키는 신약을 연구한다. 노바티스는 선도적인 글로벌 제약 기업으로 획기적인 과학기술과 디지털 기술을 활용해, 의학적 니즈가 큰 분야에서 혁신적인 치료법을 개발하고 있다. 자사는 지속적인 신약 발굴을 위해 연구개발에 투자하는 세계 최고의 기업입니다. 전 세계 7억 5천만 명 이상이 노바티스 제품을 사용하고 있는 가운데, 자사는 신약 접근성을 높이기 위한 혁신적인 방법을 고민하고 있다. 현재 세계 140개국 이상에서 약 10만 5천 명의 노바티스 직원들이 일하고 있다. 자세한 내용은 www.novartise.com에서 볼 수 있다.
노바티스는 트위터를 운영하고 있다. 가입하고
http://twitter.com/novartis에서 노바티스를 팔로우 하세요. 노바티스의 멀티미디어 콘텐츠를 보려면 www.novartis.com/news/media-library에 방문하시고, 사이트 또는 가입에 대한 문의는 media.relations@novartis.com으로 문의하세요.
한국노바티스(Novartis Korea)에 대하여
세계적인 제약•바이오기업, 노바티스의 자회사인 한국노바티스(www.novartis.co.kr)는 계열사인 한국산도스을 포함해 약 580여 명의 직원을 두고 있다. 한국노바티스는 지난 10년간 한국에서만 약 200여 건의 임상시험을 진행하여 국내 연구진과의 협력을 활발히 진행하고 있으며, 환우 및 가족 정서 지원 프로그램인 ‘치유(CHEER YOU)’, 환우의 사회 복귀지원프로그램 ‘이음’, 여성 암 환자 지원프로그램인 ‘가화맘사성’과 매년 전 직원이 자원봉사활동에 참여하는 ‘지역사회 봉사의 날’ 행사 등 다채로운 사회공헌활동을 통해 지역사회에 이바지 하는 기업이 되기 위해 최선을 다하고 있다.
References
1. Braliakos X. et al. OP0235 Secukinumab improves axial manifestations in patients with psoriatic arthritis and inadequate response to NSAIDS: primary analysis of the MAXIMISE trial. Presented at the annual European League Against Rheumatism (EULAR) 2019.
2. Mease P, et al. Subcutaneous secukinumab 300mg and 150mg provides sustained inhibition of radiographic progression in psoriatic arthritis over 2 years: Results from the Phase 3 FUTURE-5 trial. Presented at the Annual European Congress of Rheumatology (EULAR); June 12–15, 2019; Madrid, Spain.
3. JOY FELD, VINOD CHANDRAN and DAFNA D. GLADMAN, What Is Axial Psoriatic Arthritis?. J Rheumatol 2018;45;1611-1613
4. Novartis, data on file. May 2019
5. Gossec L, Smolen JS, Ramiro S, et al. Ann Rheum Dis 2016;75:499-510
6. Mease P, et al. Secukinumab provides sustained improvements in the signs and symptoms in psoriatic arthritis: final 5 year efficacy and safety results from a phase 3 trial, 2018 ACR/ARHP Annual Meeting
7. Baraliakos X et al. Long-term evaluation of Secukinumab in ankylosing spondylitis: 5 year efficacy and safety results from a phase 3 trial. Presented as a late-breaking abstract at the American College of Rheumatology Annual Meeting, 2018.
8. Bissonnette, R et al. Secukinumab demonstrates high sustained efficacy and a favorable safety profile in patients with moderate to severe psoriasis through 5 years of treatment (SCULPTURE Extension Study). J Eur Acad Dermatol Venereol. 2018;32: 1507-1514
9. Landewe R and Van Tubergen A. Clinical tools to assess and monitor spondyloarthritis. Curr Rhen Rep 2015;17(7):47
11. Reich, K et al. Secukinumab Shows Sustained Efficacy in Difficult-to-Treat Palmoplantar, Nail, and Scalp Psoriasis: Long-term Results From 3 Phase III Placebo-Controlled Randomized Trials. Presented as a Late Breaking Poster #6 at the 3rd Inflammatory Skin Disease Summit (ISDS), Vienna. December 2018.
12. 코센틱스, 제품설명서