생체 환경에서 암 줄기세포와 결합 … 항암 효능도 확인
A NIR probe tracks and treats lung tumor initiating cells by targeting HMOX2
암 줄기세포만 선택적으로 추적하는 새로운 형광물질이 개발됐다. 기초과학연구원(IBS, 원장 김두철) 복잡계 자기조립 연구단(단장 김기문) 장영태 부연구단장 연구팀은 암 줄기세포를 표적하는 형광물질 타이니어(TiNIR)1 를 개발하고, 동물실험을 통해 항암 치료 가능성을 확인했다.
우리의 신체는 줄기세포를 통해 성장과 재생을 반복한다. 암 조직에도 줄기세포가 있다. 종양근원세포로도 불리는 암 줄기세포는 종양을 생성할 수 있는 능력을 가진 세포다. 수술이나 항암치료로 눈에 보이는 암을 제거하더라도 암 줄기세포가 살아남으면 재발 확률이 높아진다. 게다가 암 줄기세포는 손상된 암세포를 복구시키고, 세포 밖으로 약물을 배출시키는 특성이 있어 암 치료를 더 어렵게 만든다.
암의 근본적인 치료를 위해서는 암 줄기세포를 식별해 제거하는 일이 중요하다. 하지만 기존 탐지 기술은 암 줄기세포만을 뚜렷하게 구분하기 어려웠다. 또 탐지체(프로브)가 세포 내부 바이오마커에 접근하지 못해 생체 환경에서 탐지가 어렵다는 한계도 있었다.
연구진은 암 줄기세포에서 HMOX2 HMOX22라는 단백질이 특이적으로 높게 발현됨을 확인하고, 이를 바이오마커로 표적해 결합할 수 있는 새로운 형광 프로브 타이니어(TiNIR)를 개발했다.
저농도의 타이니어를 세포에 주입하면 HMOX2 단백질과 결합해 적외선 영역의 형광을 내며 암 줄기세포를 시각화한다. 살아있는 암 줄기세포를 염색하지 못했던 기존 기술의 한계를 극복한 것이다. 이후 생쥐에 타이니어를 직접 주입해본 실험에서도 높은 선택성으로 살아있는 암 줄기세포를 추적할 수 있음을 확인했다.
1 TiNIR(TIC NIR probe): 종양근원세포(TIC, 암 줄기세포)를 탐지하면 근적외선 영역대의 빛을 내는 형광물질을 말한다.
2 HMOX2(Heme Oxygenase 2): 헤모글로빈의 색소 성분인 헴(heme)을 분해해 생체 내 활성산소를 제거하는 효소
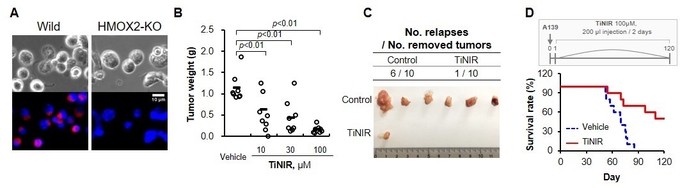
이어 연구진은 고농도 타이니어를 통한 항암 치료 효과도 확인했다. 연구진은 폐암을 유발한 생쥐에게 100μM(마이크로몰 농도)의 고농도 타이니어를 이틀 간격으로 반복 주사했다. 약물을 처리하지 않은 쥐는 종양이 점점 자라나 무게가 1.14g에 이른 반면, 고농도 타이니어를 주사한 쥐의 경우 종양의 생장이 억제돼 그 무게가 0.16g에 불과했다.
생존율도 크게 증가하는 것으로 나타났다. 암 발생 85일 이후 폐암 쥐가 생존할 확률은 거의 없지만, 고농도 타이니어를 주사한 경우 생존율이 70%까지 대폭 증가했다.
장영태 부연구단장은 “고농도의 타이니어가 HMOX2의 기능을 억제하기 때문”이라며 “HMOX2의 기능이 억제되면 암 줄기세포 내 활성산소종(ROS)이 축적되고, 이는 세포의 자살을 유도하는 것은 물론 줄기세포로서의 특성을 잃게 만든다”고 설명했다.
이번 연구는 암 줄기세포를 환자에서 추적하고 제어할 수 있는 형광물질 기반 프로브를 개발한 것으로, 향후 암의 사후 관리와 치료율 향상에 기여할 것으로 기대된다. 암 줄기세포가 다른 기관으로 암을 전이시키는데도 관여하는 것으로 알려진 만큼, 연구진은 향후 추가 연구를 통해 암의 전이 능력까지 억제할 수 있는 프로브를 찾아 나설 계획이다.
장 부연구단장은 “이번 연구는 새로운 바이오마커와 형광 프로브의 발견을 통해 암 치료의 새로운 가능성을 제시했다”며 “폐암뿐만 아니라 다른 종류의 암도 표적할 수 있음이 확인된 만큼 추가 연구를 통해 범용 암 치료제를 개발해볼 계획”이라고 말했다.
연구결과는 화학분야 권위지인 미국화학회지(JACS, Journal of the American Chemical Society, IF 14.695) 8월 22일자 온라인 판에 실렸다.
논문명
A NIR probe tracks and treats lung tumor initiating cells by targeting HMOX2
저자정보
Jong-Jin Kim, Yong-An Lee, Dongdong Su, Jungyeol Lee, Sung-Jin Park, Beomsue Kim, Jia Hui Jane Lee, Xiao Liu, Seong Soon Kim, Myung Ae Bae, Jun-Seok Lee, Seong Cheol Hong, Lu Wang, Animesh Samanta, Haw-Young Kwon, So-Young Choi, Jun-Young Kim, Young Hyun Yu, Hyung-Ho Ha, Zhenxun Wang, Wai Leong Tam, Bing Lim, Nam-Young Kang, and Young-Tae Chang
연구내용
보충설명
본 연구는 TiNIR 프로브의 두 가지 특성을 확인한 연구이다. 시험관 실험에서 (세포 실험) 종양근원세포를 추적하여 분리 후 배양하기 위한 독성이 없거나 낮은 농도는 10 – 100 nM 이다. 폐종양이 유도된 생쥐에서 종양근원세포를 시각화하고 분리하기 위해서는 100 μM을 주사하였다. 단회 100 μM 주사 후 분리된 종양근원세포는 시험관에서 배양이 잘 되었으며, 이러한 이유로 생체 단회 투여의 100 μM TiNIR은 세포 독성이 없는 것으로 확인되었다. 종양근원세포를 억제하여 치료 효과를 확인하기 위해. 100 μM의 TiNIR를 이틀 간격으로 반복적으로 (최소 13회) 주사하였으며, 이때는 명확한 종양 억제 및 생존증가 효과를 관찰하였다.
실험에 사용한 종양근원세포의 종양형성 능력 및 세포의 유지는 다음과 같이 진행하였다. 종양근원세포의 종양형성 능력: 다양한 종류의 종양에서 종양근원세포의 존재가 확인 된 이후 바이오마커를 이용한 종양근원세포의 분리 기술이 연구되어 왔다. 분리된 세포의 종양형성능력의 검증은 분리 기술의 효율성에 있어서 중요한 판단 기준이 된다. 가장 널리 알려진 방법으로는 NOD.Cg-PrkdcscidIl2rgtm1Wjl /SzJ (NSG)와 같은 면역력결핍마우스에 세포를 이식 후 이식된 자리에서의 종양의 형성여부의 관찰을 통해 종양형성능력을 검증 할수 있다. 체외배양을 통해 역시 그 능력은 검증 될 수 있으며, 종양구(tumor sphere)의 형성은 자가증식이 가능한 종양근원세포가 일반 종양세포와 구분되는 능력이다. 따라서 분리된 세포의 종양구 형성능력의 검증을 통해 종양근원세포임이 확인된다. 본 연구에서 DOFLA 스크리닝을 위해 사용된 종양근원세포주는 폐암 환자의 종양에서 분리된 세포로서 종양구 배양 방법을 통해 그 종양형성능력 유지되었다.
기타사항
[연구 배경]
종양근원세포 (tumor initiating cells)를 추적하고 특성을 확인하기 위하여 다양한 항체가 개발되었으며 뇌, 유방, 간, 폐암 등에 성공적으로 적용되었다. 그러나 항체를 이용한 종양근원세포 추적은 종종 정상 줄기세포와 공유되며, 일반적으로 종양근원세포를 표적화하기 위해서 다중 항체조합이 요구된다. 또한, 바이오마커가 세포표면에 노출되지 않는 경우, 항체의 표적에 대한 접근이 한계가 있다. 이러한 한계를 극복하기 위하여 Diversity Oriented Fluorescence Library Approach (DOFLA)를 개발하였다. 지난 10여년 동안 우리 연구팀에서는 DOFL 스크리닝을 통해 특정 세포에 특이적으로 결합하는 프로브들을 개발하여 발표한 바 있다. 라이브러리를 구성하는 저분자 물질의 특성에 따라, 세포질 내에서 발현되는 바이오마커를 살아있는 상태로 결합하는 프로브 개발을 보인 것이다. 연구진은 이전 연구에서 vimentin에 결합하여 종양근원세포를 추적하는 TiY를 개발하였으며, 따라서 본 연구는 그동안의 연구 성과를 바탕으로 종양근원세포를 생체에서 추적하고 시각화하며, 치료할 수 있는 프로브 개발이 가능할 것으로 기대하였다.
[연구 과정]
종양근원세포와 비종양근원세포를 이용하여 선별된 TiNIR는 더 확장된 세포종류에서 종양근원세포 선택성이 확인되었으며, 환자 유래의 시료를 이용한 종양유도생쥐 (PDX: patient-derived xenograft model)에서도 종양근원세포의 시각화 및 추적, 세포분리에 성공하였다. TiNIR와 결합하는 파트너 단백질을 gel running 실험, LC-MS 분석, RNA-seq 분석을 이용하여 종합적으로 확인하였고, 새로운 바이오마커인 HMOX2를 발굴하였다. 바이오마커의 검증을 위하여 knock-out 실험을 진행하였으며, 이때 본 바이오마커가 치료목적의 이용될 수 있다는 가능성을 확인하였다. 세포 실험에서 고농도의 TiNIR가 ROS를 세포 내에 농축시키고, 결국 세포자살을 유도한다는 것을 확인하였다. 이러한 현상은 생쥐실험에서 반복적인 TiNIR의 투여에 의해 검증되었으며, 종양 생장의 억제, 수술 후 재발 억제, 종양 유도 생쥐의 생존율 증가 등의 의미 있는 결과를 확인하였다.
[어려웠던 점]
TiNIR의 종양 재발 억제 효과를 확인하기 위한 직접적인 방법은 생쥐에 종양을 유도하고 이를 다시 수술로 제거 후 TiNIR를 주사하여 재발 억제를 확인하는 것이 가장 직접적인 방법이다. 본 실험의 객관성을 위해 모든 종양 조직을 깨끗이 제거하고 또한 봉합 후 생쥐를 생존시키는 것에 많은 집중력과 노력이 필요했었다. 또한, 종양 유도 생쥐의 생존 실험에서 이틀 간격으로 총 120일 동안 생쥐의 꼬리의 건강한 상태로 유지하며 TiNIR를 꼬리정맥으로 주사하는 실험도 많은 집중력이 필요한 실험이었다.
[성과 및 차별점]
이번 연구결과는 세포질에서 발현하는 단백질인 HMOX2를 표적으로 하는 종양근원세포 프로브, TiNIR를 개발하였으며, TiNIR의 농도 및 사용 방법에 따라 종양근원세포의 추적과 치료, 두 가지 역할을 할 수 있는 프로브 개발을 보여 준 사례이다.
[향후 연구계획]
종양근원세포의 특징 중의 하나는 다른 기관으로 암의 전이를 유도한다는 것이다. 밝혀진 TiNIR의 치료 능력 이외의 암의 전이 능력 억제를 연구할 계획이다. 또한, 프로브가 세포를 염색하는 기작은 프로브를 세포 내로 수송하는 소송체, 세포 내에서 결합하는 단백질, 세포 외부로 분비하는 수송체에 의하여 조율되기 때문에 다음 연구에서 TiNIR의 세포 염색 메커니즘을 수송체를 조율함으로써 연구할 계획이다.
연 구 추 가 설 명
그림 설명
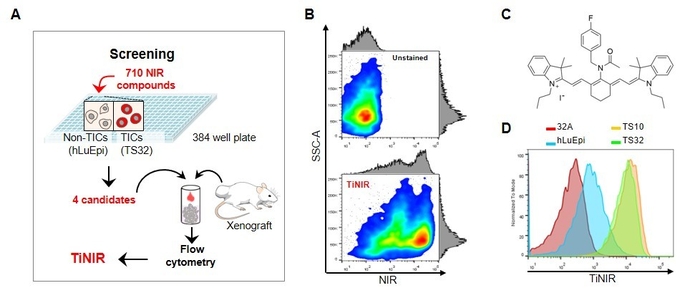
연구진은 710개의 형광물질을 보유한 라이브러리를 구축하고, 고속처리검색법을 통해 폐암 종양근원세포를 선택적으로 염색할 수 있는 근적외선 프로브를 발굴했다(A). 최종적으로 선택된 타이니어(TiNIR)는 종양근원세포를 선택적으로 염색해 구분할 수 있다(B). (C)는 타이니어의 분자 구조를, (D)는 타이니어가 다양한 세포 중에서 종양근원세포(TS10, TS21)를 뜨렷하게 구분할 수 있음을 보여준다.
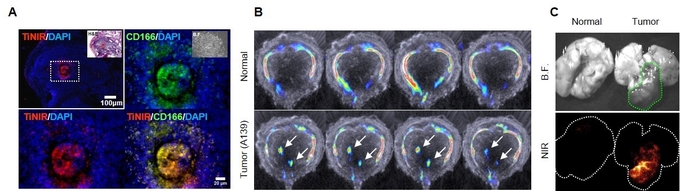
종양이 유도된 생쥐의 폐에서 타이니어가 종양근원세포를 붉은 색으로 물들임을 확인할 수 있다(A). 타이니어는 기존 탐지체와 달리 살아있는 암 줄기세포를 염색할 수 있다. (B)는 폐종양 유도 생쥐에서 종양근원세포를 포함하는 종양조직을 시각화한 모습이며 (C)는 폐종양의 이미지화한 모습.
(A)HMOX2 단백질을 제거(녹아웃)한 세포에서 타이니어의 염색양상 변화. (B) 타이니어에 의한 종양 무게 감소를 보여주는 그래프. (C)종양 제거 후 타이니어 주사에 의해서 종양 재발이 감소됨을 확인할 수 있다. (D)타이니어 꼬리정맥 주사에 의한 종양 유도 생쥐의 생존율 증가.