여포형 림프종 2차 이상 치료에 '가싸이바® + 벤다무스틴' 병용요법시 본인부담률 각 30%, 이후 '가싸이바®' 단독요법(유지요법)시 본인부담율 30%로 선별 급여
GADOLIN 임상 결과, 여포형 림프종 환자에서 가싸이바®+벤다무스틴 병용 유도요법 후 가싸이바® 유지요법군, 벤다무스틴 단독요법군 대비 질병 진행 위험 52% 감소 등 유효성 입증
㈜한국로슈(대표이사 닉 호리지)는 자사의 여포형 림프종 및 만성 림프구성 백혈병 치료제 가싸이바®가 12월 15일부터 여포형 림프종의 2차 이상 치료에 선별 급여로 건강보험이 적용된다고 밝혔다.
이번에 적용된 가싸이바®의 건강보험 급여기준에 따르면, 여포형 림프종(소포 림프종, Follicular lymphoma)의 2차 이상 치료에 '가싸이바® + 벤다무스틴' 병용요법 시 가싸이바®, 벤다무스틴 각각 본인부담률 30%씩, 이후 '가싸이바®' 단독요법(유지요법)시 본인부담율 30%로 선별 급여가 적용된다.
가싸이바®의 이번 급여 확대는 리툭시맙 요법에 불응하거나 재발한 여포형 림프종 환자에서 유효성을 입증한 GADOLIN 임상 연구 결과를 기반으로 이뤄졌다. GADOLIN 연구는 여포형 림프종 환자 335명을 포함해 리툭시맙으로 치료가 되지 않거나 재발한 18세 이상 CD20 양성 지연성 비호지킨 림프종 환자 413명를 대상으로 진행된 3상, 1:1 무작위 배정, 오픈라벨 연구이다.
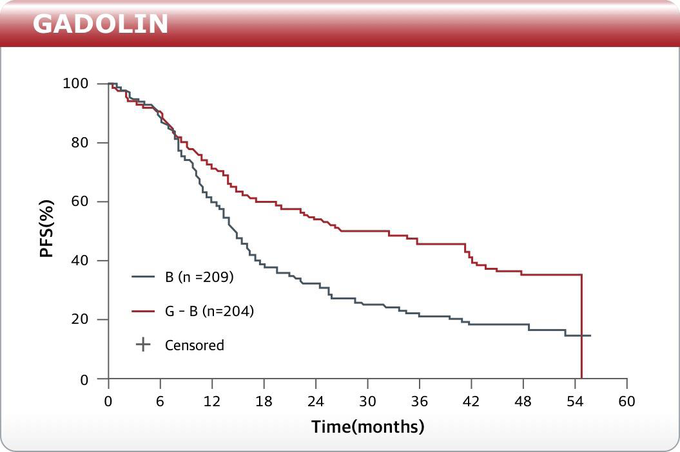
GADOLIN 연구에서 여포형 림프종 환자 대상으로 분석된 결과에 따르면 가싸이바®+벤다무스틴 병용 유도요법 후 가싸이바® 유지요법군(가싸이바® 병용 요법군)은 벤다무스틴 단독요법군 대비 질병 진행의 위험을 52% 감소시킨 것으로 나타났다(독립 연구 위원회 평가 무진행 생존기간: 가싸이바® 병용 요법군 도달하지 않음 vs. 벤다무스틴 단독요법군 13.8개월, HR 0.48; 95% CI 0.34-0.68, p<0.0001). 안전성의 경우 여포형 림프종 환자 대상으로 분석한 결과 3-5등급 이상반응 발생률이 가싸이바® 병용요법 군에서 70.7%, 벤다무스틴 단독요법 군에서 63.9%로 나타났다.
2014년 9월 만성 림프구성 백혈병 치료제로 허가를 받은 가싸이바®는 2017년 4월 여포형 림프종 적응증을 추가, 같은 시기 CD20 양성B세포 만성 림프구성 백혈병 치료에 대한 보험 급여를 적용 받았다. 당시 적용된 보험 기준에 따르면 CD20 양성인 B세포 만성 림프구성 백혈병으로 진단받은 환자 가운데 ▲70세 이상 고령자 ▲누적 질환 평가 스케일(CIRS)이 6보다 높은 경우 ▲크레아티닌 청소율이 분당 30~69ml인 경우 중 한 가지 이상 만족할 때 클로람부실과 병용해 투여 주기 6주기 기준으로 보험 급여가 한정됐었다. 이번 급여 확대로 불응/재발성 여포형 림프종(소포 림프종, Follicular lymphoma) 환자도 선별 급여로 보험을 적용 받아 가싸이바®를 사용할 수 있게 됐다.
한국로슈 닉 호리지 대표이사는 “가싸이바®의 급여 기준 확대는 더욱 다양한 치료 옵션을 필요로 하는 국내 여포형 림프종 환자들에게 희소식이 될 것”이라며, “재발에 대한 두려움을 안고 살아가는 여포형 림프종 환자들에게 이번 보험 급여 확대가 생존 기간 연장과 질병 진행 위험 감소뿐 아니라, 궁극적으로 환자 삶의 질의 제고로도 이어질 수 있기를 희망한다”고 밝혔다.
가싸이바®에 대하여
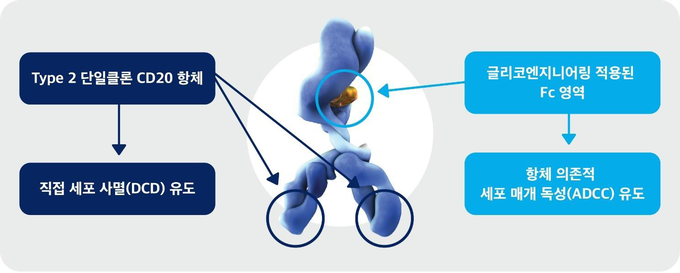
한국로슈의 여포형림프종 치료제 가싸이바®는 최초의 Type 2 글리코엔지니어드, 인간화단일클론 CD20 표적치료제로, FDA가 지정한 최초의 혁신치료제(Breakthrough Therapy)다.
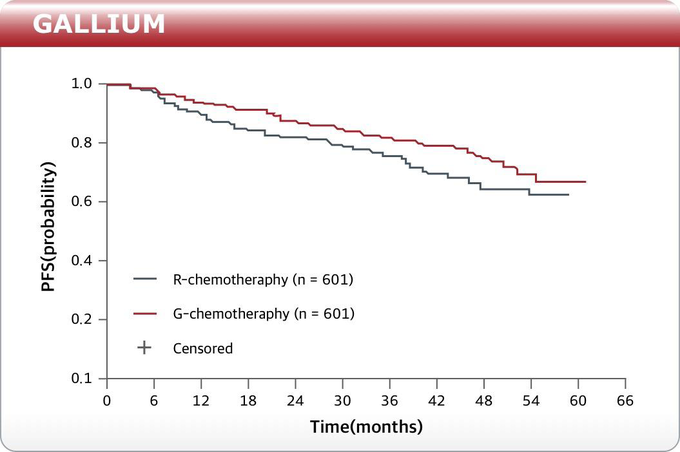
지난 2017년 4월 여포형림프종 치료제로 국내허가를 받았으며, GADOLIN임상을 통해 기존 리툭시맙요법에 불응/재발한 여포형림프종 환자의 치료에서 유효성을 입증했다.2 또한, 가싸이바®는 GALLIUM임상을 통해 이전 치료경험이 없는 여포형림프종 환자에서 리툭시맙요법 대비 치료후 질병진행의 위험을 감소시키는 것으로 확인됐다.
이에, 미국 국가종합암네트워크 (NCCN) 가이드라인에서는 가싸이바®를 여포형림프종 유도 및 유지요법으로서 권고하는 등 여포형림프종 환자에게 효과적인 치료옵션으로써 기대를 모으고 있다.
한편, 가싸이바®는 지난 2014년 4월 국내에서 만성림프구성 백혈병 환자에 대한 희귀의약품으로 지정되었으며, 같은 해9월 만성림프구성 백혈병 치료제로 국내허가를 받았다.4 만성림프구성 백혈병 치료에 대해서도 가싸이바®는 미국 국가종합암네트워크 (NCCN) 가이드라인에서 만성림프구성 백혈병 1차요법중 선호되는 요법으로 권고되고 있다.
GADOLIN 임상에 대하여
|
GADOLIN
study
|
|
대상3
|
-
18세 이상 리툭시맙으로 치료가 되지 않거나 재발한 CD20 양성 지연성 비호지킨림프종 환자 413명 (여포형 림프종 환자 335명 포함)
|
|
투여군3
|
-
가싸이바®+벤다무스틴 병용 유도요법후 가싸이바® 유지요법군(“가싸이바® 병용요법군”), 벤다무스틴 단독 유도요법군(“단독 요법군”)
|
|
방법3
|
-
3상, 1:1 무작위배정, 오픈라벨
|
|
여포형림프종
주요
결과
|
Primary
Endpoint2
|
-
독립평가위원회 평가
무진행생존기간
(Indepent Review Committee-assessed PFS):
가싸이바® 병용요법군
도달하지 않았음 vs. 단독요법군 13.8개월 (HR
0.48; 95% CI; 0.34-0.68, p<0.0001)
|
|
Secondary
Endpoint3
|
-
연구자평가
무진행생존기간(Investigator-assessed
PFS):
가싸이바® 병용요법군 25.3개월 vs. 단독요법군 14.0개월 (HR
0.52; 95% CI; 0.39-0.69, p<0.001)
-
전체
생존기간(Overall
survival):
가싸이바® 병용요법군
도달하지 않았음 vs. 단독요법군 53.9 개월 (HR
0.58; 95% CI; 0.39-0.86; p=0.0061)
-
치료단계
전환 소요시간(Time to
start of new antilymphoma treatment):
가싸이바® 병용요법군 33.6개월 vs. 단독요법군 18.0개월 (HR
0.57; 95% CI; 0.43-0.75)
|
|
여포형림프종
하위연구분석[i]
|
-
미세
잔존질환 (MRD,
minimal residual disease)
유도요법
종료 이후 MRD 음성률: 가싸이바 병용요법군 86% vs. 단독요법군55%
(p=0.0002)
양치료군에서 MRD 음성을 보인 환자는 양성 환자 대비 향상된 무진행생존기간(HR 0.33,
95% CI; 0.19- 0.56, p<0.0001) 및 전체생존율(HR 0.39, 95% CI; 0.19- 0.78,
p=0.008)을 보임
|
|
안전성3
|
-
3~5등급 이상반응:
가싸이바® 병용요법군70.7% vs.
단독요법군 63.9%
|
References
1 건강보험심사평가원공고제2019-386호, 2019.11.29
3 Cheson B, et al., Overall Survival Benefit in Patients With RituximabRefractory Indolent Non-Hodgkin Lymphoma Who Received