gBRCA 변이가 있는 전이성 유방암에서 항암화학요법 대비 질병 진행 및 사망 위험 42% 감소[2]
새로 진단 받은 BRCA 변이 진행성 난소암에서 위약 대비 연구자 선정 질병 진행 및 사망 위험 70% 감소[3]
한국아스트라제네카(대표이사 사장 김상표)는 12월 4일 기자간담회를 통해 최초의 PARP 저해제인 ‘린파자 (성분명 올라파립)[4]’가 새로운 제형으로 난소암과 유방암에서 추가한 적응증의 근거가 된 주요 임상 연구 결과와 임상적 가치에 대해 소개했다.
린파자는 지난 10월 29일 기존 캡슐형에 정제형을 추가하면서, PARP 저해제로서는 최초로 유방암 영역에서 적응증을 획득하는 동시에1, 기존 2차 유지요법만으로 사용되어 온 난소암 치료 적응증을 1차 유지요법으로 확대하는 등 PARP 저해제의 치료 저변을 크게 확대한 바 있다.
이날 행사에서는 각 적응증 획득의 배경이 된 주요 임상연구에 참여한 국내 의료진 2인을 초청, 주요 연구 결과와 함께 PARP 저해제를 통한 정밀 의료(Precision Medicine)의 의미와 가능성에 대해 논의하는 자리를 가졌다.
gBRCA 변이가 있는 전이성 유방암 적응증 획득의 근거가 된 OlympiAD 연구의 책임연구자로 발표를 맡은 서울의대 혈액종양내과 임석아 교수는 ‘BRCA 변이를 지표로 하는 전이성 유방암 치료의 최신지견’을 주제로 발표를 하면서, “OlympiAD 연구에서 올라파립(olaparib)은 전이성 유방암 치료영역에 있어 표준치료법 대비 사망 및 질병진행의 위험을 42% 감소시켰다. 특히 치료옵션이 몹시 제한적이었던 삼중음성 전이성 유방암 환자에게서 표준치료 요법이었던 항암화학요법보다 우월한 임상적 가치를 입증했다”며 “린파자 적응증 허가를 계기로 유방암 영역에서 BRCA변이를 지표로 한 환자 맞춤 정밀 의료의 가능성이 열린만큼 더 많은 유방암 환자들이 최적의 치료를 받을 수 있도록 BRCA 검사의 보험급여 인정 범위도 확대될 수 있도록 노력해야 한다”고 제언했다.
OlympiAD 연구 결과, 린파자는 항암화학요법 대비 질병 진행 및 사망 위험을 42% 감소시킨 것으로 나타났다 (HR=0.58; 95% CI, 0.43 to 0.80; p<0.001)2. 약물 반응률(Response Rate)에서도 린파자군은 59.9%로 항암화학요법군(28.8%) 대비 2배 이상 높은 반응률을 나타냈다2.
린파자군의 무진행 생존기간 중앙값(mPFS)은 7.0개월, 항암화학요법군은 4.2개월 이었고, 12개월 무진행 생존율(PFS)은 린파자군과 항암화학요법군 각각 25.9%, 15%로 확인됐다2.
2차 평가변수인 전체생존률은 두 군간 유의한 차이를 보이지 못했으나 (HR=0.90 (95% CI, 0.63–1.29); P=0.57)2, 특히 전이된 유방암 단계에서 항암화학요법을 받지 않고 올라파립으로 먼저 치료 받은 환자 하위군에서는 대조군 대비 유의한 차이의 생존률 (Overall survival) 개선 효과를 보였다 (HR 0.51 (95% CI 0.29, 0.90); P= 0.02)[5].
3등급 이상의 이상반응을 보인 환자는 린파자군의 36.6%, 항암화학요법군은 50.5%로 확인되었다2. 약물 독성으로 인해 치료를 중단한 환자 비율은 린파자군은 4.9%인 반면, 항암화학요법군은 7.7%로 집계되었다.
한편, SOLO-1 연구의 저자인 성균관의대 산부인과 김병기 교수는 SOLO-1 연구의 주요 결과를 소개하며 난소암 치료에서 린파자정 유지요법의 새로운 임상적 가치를 조명했다.
김 교수는 “재발 위험이 높은 진행성 난소암 환자들을 대상으로 한 SOLO-1연구에서 치료 41개월에 가까운 시점까지 무진행 생존기간 중앙값이 도출되지 않고 효과가 유지되었다는 것은 난소암 치료의 새로운 패러다임을 제시하는 고무적인 결과”라며 “특히 이러한 린파자의 치료 효과는 모든 하위 분석군에서 일관되게 나타나 난소암 영역에서의 BRCA변이를 지표로 한 PAPR 저해제 치료의 임상적 가치를 공고히 하였다”고 연구의 의의를 설명했다.
SOLO-1연구 결과, 린파자는 연구자가 산정한 위약 대비 질병 진행 및 사망 위험을 70% 감소시켰으며(HR=0.30; 95% CI, 0.23 to 0.41; p<0.001), 두 번째 질병 진행 및 사망 위험도 위약 대비 50% 감소시켰다(HR=0.50; 95% CI, 0.35 to 0.72; p<0.001)3.
3년차 린파자군의 무진행 생존률(PFS)은 위약군 대비 두 배 이상 높았으며 (린파자군 60%, 위약군 27%), 13.8개월의 무진행 생존기간 중앙값(mPFS)을 보인 위약군과 달리 린파자군의 무진행 생존기간 중앙값은 치료 40.7개월 시점까지 도출되지 않았다3.
린파자군 중 치료를 중단한 환자는 12%, 약물 용량을 조절한 환자는 28%로 나타났으며, 대다수의 이상반응은 용량 감량과 일시적인 복용 중단으로 개선되었다3. 대부분의 이상반응은 1-2등급에 해당했고, 3등급 이상 이상반응 중 가장 흔한 것은 빈혈이었다3.
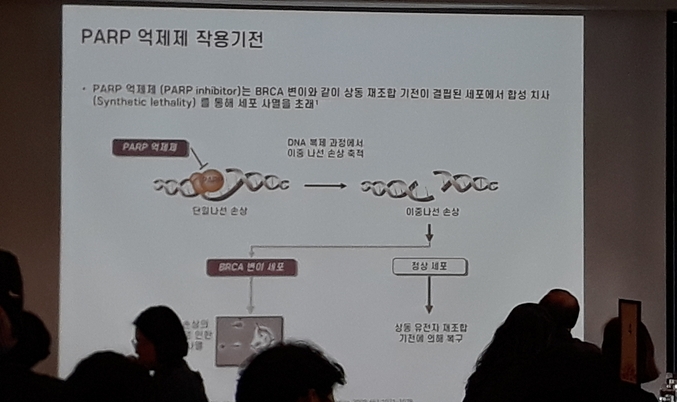
한국아스트라제네카의 린파자는 최초의 PARP 저해제4로 암세포의 분열 과정에서 손상된 DNA 복구를 돕는 PARP의 기능을 억제하여 암세포를 선택적으로 사멸시키는 기전을 가진 표적항암제다[6].
린파자 캡슐은 2015년 8월, 2차 이상의 백금 기반 항암화학요법에 반응(부분 또는 완전반응)한 백금민감성 재발성 BRCA 변이 고도 장액성 난소암, 난관암 또는 일차 복막암 성인 환자의 단독 유지요법으로 국내 허가[7] 되었다.
한편 올해 10월 린파자정으로 ▲1차 백금 기반 항암화학요법에 반응(부분 또는 완전반응)한 새로 진단된 진행성 BRCA 변이 고도 상피성 난소암, 난관암 또는 일차 복막암 성인 환자의 유지요법 ▲2차 이상의 백금 기반요법에 반응(부분 또는 완전반응)한 백금민감성 재발성 고도 상피성 난소암(난관암 또는 일차 복막암 포함) 성인 환자의 단독 유지요법, ▲이전에 항암화학요법 치료 경험이 있는 gBRCA 변이 HER2 음성 전이성 유방암 성인 환자 치료의 단독요법으로 적응증을 확대1한 바 있다.
다만 린파자 캡슐(50 mg)과 린파자 정제(100mg 및 150mg)는 각 제형의 용량 및 생체 이용률에 차이가 있으므로 밀리그램 대 밀리그램 기준으로 린파자 캡슐(50mg)을 린파자 정제(100mg 및 150mg)와 대체하여 사용해서는 안 된다1.
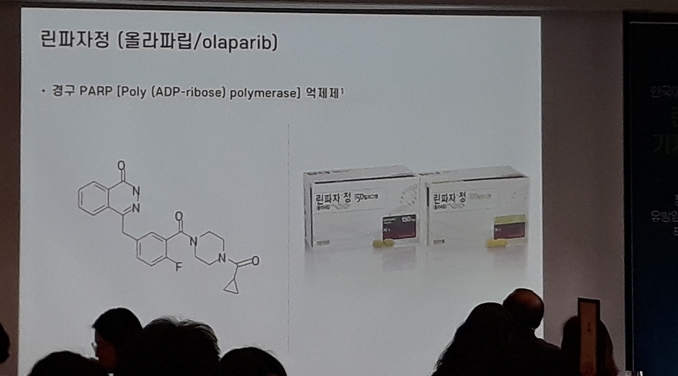
린파자(Lynparza, 성분명: 올라파립)
린파자는 최초의 PARP 저해제 (poly ADP-ribose polymerase Inhibitor)이자 BRCA1/2변이 등과 같이 상동 재조합 복구(HRR, homologous recombination repair)의 결함을 내포한 세포의 DNA 손상 반응(DDR, DNA Damage response)을 차단하는 최초의 표적 항암제다. PARP 저해제인 린파자는 PARP를 억제하여 암세포의 DNA 단일가닥 절단, 복제 지연, DNA 이중가닥 절단을 유도해 암세포의 사멸을 이끈다. 린파자는 DNA 손상복구 경로(DDR pathway) 손상 및 결함에 의한 PARP 의존형 종양을 대상으로 한 임상시험을 진행 중에 있다.
린파자는 현재 BRCA변이 여부 무관 백금 민감성 재발성 난소암의 유지요법으로 EU를 포함한 64개국에서 승인되었으며, 미국, EU, 일본을 비롯한 다수 국가에서 백금 기반 화학요법에 반응한 BRCA 변이 진행성 난소암 1차 유지요법으로 승인 되었다. 아울러, 화학 치료 경험이 있는 gBRCA 변이 HER2 음성, 전이성 유방암 치료에 미국, 일본을 비롯한 43개국 승인을 획득했으며, EU 승인의 경우 국소 진행성 유방암이 포함되었다. 난소암, 유방암, 췌장암에서 다른 적응증 승인 또한 검토 진행 중이다.
아스트라제네카와 MSD가 공동으로 개발하고 상용화한 린파자는 전세계 25,000명 이상의 진행성 난소암과 전이성 유방암 환자 치료에 사용된다. 린파자는 PARP 저해제 중 가장 광범위하며 진보된 임상 개발 프로그램을 보유하고 있다. 아스트라제네카와 MSD는 이러한 임상을 통해 다수 암종에 대한 단일 및 병용요법으로서 PARP 의존성 종양에 대한 린파자의 효과를 이해하기 위해 공동 연구를 지속하고 있다. 린파자는 암세포의 DNA 손상 반응 매커니즘을 표적으로 하는 아스트라제네카의 잠재 신약 포트폴리오의 기반이다.
아스트라제네카
아스트라제네카는 과학 중심의 글로벌 바이오 제약기업으로 항암제, 심혈관, 신장 및 대사질환, 호흡기 질환 세 가지 분야의 치료 영역을 핵심으로, 전문 의약품의 발견과 개발, 그리고 상용화에 초점을 두고 있다. 아스트라제네카는 100여개국 이상에 진출해 있으며 전 세계적으로 수백만 명의 환자들에게 혁신적인 의약품을 제공하고 있다. 자세한 사항은 www.astrazeneca.com 혹은 www.astrazeneca.co.kr을 통해 확인할 수 있다.
References
[1] 식품의약품안전처. 린파자정 허가사항. 2019
[2] ROBSON, Mark, et al. Olaparib for metastatic breast cancer in patients with a germline BRCA mutation. New England Journal of Medicine, 2017, 377.6: 523-533
[3] MOORE, Kathleen, et al. Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer. New England Journal of Medicine, 2018, 379.26: 2495-2505
[4] LORUSSO, Domenica, et al. Spotlight on olaparib in the treatment of BRCA-mutated ovarian cancer: design, development and place in therapy. Drug design, development and therapy, 2018, 12: 1501.
[5] ROBSON, M. E., et al. OlympiAD final overall survival and tolerability results: Olaparib versus chemotherapy treatment of physician’s choice in patients with a germline BRCA mutation and HER2-negative metastatic breast cancer. Annals of Oncology, 2019, 30.4: 558-566.
[7] 식품의약품안전처. 린파자캡슐 허가사항. 2019`1