한국애브비의 만성 림프구성 백혈 병치료제 ‘벤클렉스타’의 기자간담회가 4월 22일 오후 2시부터 온라인 세미나로 진행됐다.
이날 행사는 가톨릭의대 엄기성교수와 연세의대 김진석 교수 등 혈액내과 전문가들의 벤클렉스타 3차 치료 보험급여 적용 자료 및 벤클렉스타 병용요법 허가 보도자료와 관련된 임상연구 강의로 구성되었다.
강의 내용을 다음과 같이 정리해 알아본다.
벤클락스타 병용요법 2년치료 MURANO임상 효과안전성 확인
ㆍ벤클렉스타 단독요법 3차급여와함께 벤클렉스타-리툭시맙 병용요법 2차허가로 향후 치료환경에 대한 기대
- 엄기성 교수 :
기존에는 예후가 좋지 않은 17p 유전자 결손 환자에서 효과가 좋지 않은 FCR 요법을 써야 했고, 오비누투주맙-클로람부실 병용요법이 70세 이상에서 허가 받았으나 이전까지는 80세 이상 환자에서는 독성이 있는 FCR 요법을 쓸 수밖에 없다. 의학적인 원칙이나 근거에 따른 치료가 아닌 국내 허가 및 급여 사항에 따라 치료해야 할 수 밖에 없는 상황이었다.
그러나 벤클렉스타-리툭시맙 병용요법이 허가 되면서 기존 치료제인 이브루티닙이나 이델라리십 등과는 다른 차원의 반응을 기대할 수 있게 되었다. 특히, 이브루티닙 단독요법으로는 미세잔존질환-음성 도달률에 한계가 있다. 이와 달리, 깊은 단계의 반응율을 보이는 벤클렉스타-리툭시맙 병용요법이 허가되면서 전체생존율 및 무진행 생존기간 개선을 기대할 수 있게 되었다.
- 김진석 교수 :
만성백혈병일수록 다양한 기전의 약제가 반드시 필요하다.
기존의 어느 약제도 완벽하지 않기 때문에 어떤 약을 처방하더라도 결국 재발할 수밖에 없기 때문이다. 치료 옵션이 다양하지 않던 과거에는 처음에 썼던 약제를 다시 사용하는 전략을 썼기 때문에 한 번 재발하면 무진행생존기간이 매우 짧았다.
이제는 만성림프구성백혈병이 재발하더라도 벤클렉스타와 같은 기전이 다른 약제를 다양하게 쓸 수 있게되어 치료환경이 훨씬 개선된 상황이다. 향후에 개발, 출시될 신약들도 빠르게 허가 및 급여가 이루어져야 한다고 생각한다.
최근 보건당국에서도 고가의 신약에 대해서도 빠르게 급여를 적용하는 전략을 취하려고 하고 있는데, 이번 벤클렉스타의 허가 및 급여가 만성 림프구성 백혈병 치료 환경 개선의 시발점이 될 것이라고 기대되는 상황이다.
ㆍ 2년고정치료의 의미와 치료혜택
- 김진석교수 :
벤클렉스타와 리툭시맙 병용요법에 대한 임상연구(MURANO)는 2년간의 치료기간을 마치고 무치료기간(Off-treatment)을 갖는다.
고정치료기간 완료 후, 무치료기간을 갖는 것은 환자나 보건당국 입장에서 굉장히 유용한 치료혜택이다. 기존치료에서 만성림프구성백혈병 환자는 지속적으로 약을 복용하면서 독성으로 인한 부작용을 경험하게 되는데, 벤클렉스타는 2년고정치료로 치료완료후 무치료기간으로 독성발현이 최소화된다.
또한 지속적인 복용이 필요한 다른 치료제와 비교해 2년간만 복용하면되기 때문에 환자와 보건당국의 경제적부담을 줄여줄 수 있다. 또하나의 장점은 재치료(Retreatment)의 기회를 가질 수 있다는 점이다. 재치료에 대한 데이터가 많지않지만 벤클렉스타 치료완료 이후에 재발한 경우 다시 복용하면 효과가 있을 수 있다.
즉, 2년간의 고정기간으로 치료하고 3~4년가량 정상상태를 유지하다가 재발시에 다시 치료할 수 있는 기회를 가질 수 있는 것이다.
ㆍ 벤클렉스타가 3차치료에서 상당히 효과가 좋은 것으로 나타났는데, 조기에 활용하는 것과 다른 옵션을 먼저 사용하고 진행후 벤클렉스타를 사용하는 것중 어떤 옵션이 더 효과적인가?
- 엄기성교수 :
환자가 3차까지 재발하게되면 여러가지면에서 불리한 점이 많다. 여러 항암제에 노출되어 내성이 많은 암세포만 주로 남아있는 상태고, 여러치료를 받으며 환자의 전신상태도 좋지않은 상황이다. 질환이 3차, 4차로 진행한 후에 약을 쓰는 것은 하수고, 조기에 효과적인 약을선제적으로 사용하는 것이 환자의 예후 등 여러방면에서 좋을 것이라 생각된다.
- 김진석교수 :
국내에서는 1차로는 이브루티닙이나 벤클렉스타 등의 약을 쓸 수 없으나, 2차부터는 두가지 옵션이 어느정도 가능한 상황이다. 2차치료에서 급여가 되는 이브루티닙과 3차치료에서 급여가 되는 벤클렉스타의 순서를 바꾸어 치료하면 어떨까에 대한 의문이 있을텐데, 정확한 데이터는 없다.
만약, 두약제 모두 2차치료로 사용가능하다면 환자상태에 따라서 선택을 해야할 것 같다. 두가지 약제가 부작용측면에서 조금씩 차이가 있기 때문에 각 약제의 특성에 따라 환자에게 더 좋은 옵션을 선택하게될 것이다. 현재 국내에서 급여적용된 바와 같이 이브루티닙을 꼭 2차치료에, 벤클렉스타를 3차치료에 사용해야한다는 개념은 아니다.
벤클렉스타가 다소 늦게 출시되었기 때문에 현재 국내에서는 이브루티닙이 2차치료제로, 벤클렉스타는 3차치료제로 포지셔닝하고 있지만 이는 국내상황에서 그렇게 설정이 된 것이지 그 순서를 꼭 지켜야하는 것은 아니라고 이해하면 될 것 같다.
[참조]
애브비 벤클렉스타®정, 국내 허가
만성 림프구성 백혈병 환자에서 리툭시맙과의 병용요법
- 벤클렉스타®정과 리툭시맙 병용요법, 만성 림프구성 환자에서 치료 효과 유지하며 화학요법 없이 24개월 고정치료 가능한 최초의 약제
- 3상 임상시험(MURANO)에서 병용요법으로 치료 시 질병의 진행 또는 사망 위험 83% 감소, 전체생존기간(OS, Overall Survival)은 표준치료인 벤다무스틴과 리툭시맙 병용요법보다 길어져… 치료 중단 후 추적 관찰연구에서 68%는 2년간 질병 진행되지 않아
- 벤클렉스타®정과 리툭시맙 병용요법 치료 환자군 62.4%가 미세잔존질환 음성에 도달해 표준치료인 벤다무스틴과 리툭시맙 병용요법 치료 환자의 미세잔존질환 음성도달률 13.3% 대비 깊은 반응률 달성
한국애브비(대표이사 강소영)는 벤클렉스타®정(VENCLEXTA, 성분명: 베네토클락스)이 2020년 3월 26일 식품의약품안전처로부터 최소 하나의 화학요법을 포함한 이전 치료를 받은 재발성/불응성 만성 림프구성 백혈병(CLL, Chronic Lymphocytic Leukemia) 환자의 2차 병용요법 치료제로 허가 받았다.
벤클렉스타®정은 리툭시맙과 병용요법으로 치료기간은 2년으로 고정됐으나 치료 효과는 이후에도 유지되는 최초의 만성 림프구성 백혈병 치료제가 됐다.
2019년 5월, 만성 림프구성 백혈병 3차 이상 치료에서 단독요법 승인에 이어 2차 치료의 병용요법으로 허가 받으며 더 많은 환자들이 벤클렉스타®정으로 치료 받을 수 있다.
허가는 최소 하나의 화학요법을 포함한 이전 치료를 받은 적이 있는 재발성/불응성 만성 림프구성 백혈병 환자를 대상으로 한 벤클렉스타®정과 리툭시맙의 병용요법과 표준 치료인 벤다무스틴과 리툭시맙 병용요법의 효능·효과 및 안전성을 비교한 제 3상 임상시험(MURANO) 결과를 기반으로 했다.
일차 평가지표 분석 결과, 벤클렉스타®정과 리툭시맙의 병용투여군의 무진행생존기간이 유의미하게 긴 것으로 나타났다.
질병의 진행 또는 사망 위험이 83%(HR: 0.17; 95% CI: 0.11-0.25; p<0.001) 감소했고, 전체생존율이 표준 치료인 벤다무스틴과 리툭시맙 병용투여군(HR: 0.48; 95% CI: 0.25-0.90; 중앙값에 도달하지 않음)에 비해 더 높게 나왔다.
또한, 3상 임상시험(MURANO)의 추적 관찰연구(Post-Treatment Follow-up Study)에서는 질병의 진행 없이 2년 간의 투약을 마친 130명의 벤클렉스타®정-리툭시맙 병용군 환자에 대한 투약 후 18개월, 24개월에서의 무진행생존율 추정값은 각각 75.5% (95% CI 67.4, 83.7)와 68.0% (95% CI 57.6, 78.4)였다.
만성 림프구성 백혈병은 1차 치료에 불응하거나 치료 이후 재발할 가능성이 매우 높은 질환이기 때문에 이러한 환자에서 더욱 효과적이고 다양한 치료 옵션이 반드시 필요하다.
벤클렉스타®정과 리툭시맙 병용요법 허가로 재발성/불응성 만성 림프구성 백혈병 환자들이 기존 표준치료보다 더욱 효과적인 치료를 받을 수 있게 되었으며 특히, 높은 미세잔존질환-음성 도달률에서 볼 수 있듯이 깊은 반응을 얻을 수 있는 치료 옵션으로 기타 항암치료 없이 2년간의 고정치료가 가능해져 좀더 빠른 단계에서 완치 가능성은 높이고 사망 위험을 줄일 수 있게 될 것이다.
이차 평가지표는 병용요법 치료가 종료되는 시점(9개월)의 미세잔존질환(MRD, Minimal Residual Disease)을 기준으로 측정되었다.
벤다무스틴과 리툭시맙 병용요법으로 치료 받은 환자군의 13.3%가 말초혈액에서 미세잔존질환 음성에 도달한 것과 달리, 벤클렉스타®정과 리툭시맙 병용요법으로 치료 받은 환자군은 62.4%가 미세잔존질환 음성에 도달했다.
미세잔존질환은 말초 혈액이나 골수에 남아 있는 백혈병 세포 숫자로 10,000개의 백혈구 중 1개 미만의 만성 림프구성 백혈병 세포가 존재할 때 미세잔존질환-음성으로 평가한다.
65세 이상의 고령에서 주로 발생하는 만성 림프구성 백혈병은 혈액 내 림프구가 비정상적으로 증가하는 질환이다.
서구에서는 가장 흔한 백혈병이지만 국내에서는 전체 백혈병의 약 0.4%~0.5%에 불과해 희귀 혈액암으로 분류된다. 급성 혈액암에 비해 상대적으로 서서히 진행되지만 여러 번의 치료에도 불응하거나 자주 재발할 수 있기 때문에 후속 치료 단계에서 다양한 치료법이 필요하다.
벤클렉스타®정과 리툭시맙 병용요법 허가로 재발성/불응성 만성 림프구성 백혈병 환자들이 질병의 진행 없이 생명 연장의 기회를 가질 수 있게 되었다.
무치료 기간(Off-treatment)으로 독성 발현을 최소화하고 치료 기간이 2년으로 고정되어 환자의 경제적 부담을 감소시킬 수 있어, 여러 측면에서 환자 삶의 질이 개선될 것이며 더 많은 만성 림프구성백혈병 환자들이 벤클렉스타®정으로 치료할 수 있다.
벤클렉스타®정 임상시험 프로그램
MURANO: 벤클렉스타®정 치료 이전에 최소 하나의 화학요법을 포함한 이전 치료를 받은 적이 있는 재발성·불응성 만성림프구성백혈병 환자 389명이 다국가, 다기관, 오픈 라벨, 무작위 배정연구인 제3상 임상시험(MURANO)에 참여했다. 해당 연구는 벤클렉스타®정과 리툭시맙 병용군(N=194)과 벤다무스틴과 리툭시맙 병용군(N=195)의 유효성과 안전성을 비교 평가하기 위해 설계되었다. 이 연구에 참여한 환자 나이의 중앙값은 65세이다(범위: 22 ~ 85).
일차 평가지표는 연구자 평가 무진행 생존율이었다. 일차 평가지표 분석 결과, 벤클렉스타®정과 리툭시맙의 병용군에서는 무진행생존율의 중앙값에 도달하지 않았으며, 벤다무스틴과 리툭시맙의 병용군에서는 17.0개월이었다(HR for progression or death: 0.17; 95% CI: 0.11, 0.25; p<0.001). 결과 분석 당시의 추적기간 중앙값은 23.8개월이었다(범위: 0개월 ~ 37.4개월).
벤클렉스타®정 보험급여 인정
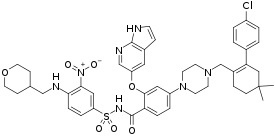
국내 최초이자 유일한 경구용 B세포림프종-2 (BCL-2, B-cell lymphoma-2) 억제제인 한국애브비의 벤클렉스타®정(Venclexta, 성분명: 베네토클락스)은 세포자멸사(Apoptosis)를 저해하는 BCL-2 단백질에 선택적으로 결합해 암세포가 비정상적으로 증식하고 악화되는 것을 막는 새로운 기전의 만성림프구성백혈병 치료제로, 2019년 5월 만성림프구성백혈병 3차이상 치료에서 단독요법으로 허가받은바 있다.
벤클렉스타®정이 보건복지부고시에 따라 2020년 4월1일부터 화학요법 및 B세포수용체 경로저해제에 재발 또는 불응인 만성림프구성백혈병 환자의 3차치료제로 보험급여가 인정된다.
이번 보험급여 적용으로 벤클렉스타®정 10mg, 50mg, 100mg 각각의 약가는 4,469원, 22,341원, 44,682원으로 정해졌으며, 1일 1회 400mg 기준 한달 투여시, 월 26만 8천원대로 벤클렉스타로 치료를 받을 수 있다.
희귀혈액암인 만성림프구성백혈병은 완치되기 어렵고 지속적인 재발을 반복하는 질환으로, 재발할 때마다 적절한 치료를 받지 못하면 생존율이 급격히 감소하게 된다.
이같은 질환특성상 효과적이고 다양한 후속 치료약제가 반드시 필요하다.
2019년 벤클렉스타®정이 국내에 허가되어, 기존치료에 실패하거나 재발한 환자들에게 새로운 치료옵션을 제공할 수 있다.
벤클렉스타®정의 보험급여 적용으로 기존치료에 재발하거나 불응인 만성림프구성백혈병 환자들이 경제적인 부담을 줄이면서 효과적인 치료를 받을 수 있게 되었고,이로 인하여 삶의 질이 개선되고 생명연장의 혜택을 누릴 것으로 기대한다.
벤클렉스타®정은 치료 5주차 1일 투여량 400mg까지의 증량일정에 따라 투여해야 하며 1주차 20mg, 2주차 50mg, 3주차 100mg, 4주차 200mg, 5주차 400mg까지 용량을 증량하여 복용한다. 이와같은 증량일정이 완료되면 1일 1회 400mg으로 용량을 유지한다.
벤클렉스타®정 임상시험 프로그램
M13-982: 이전 치료경험이 있는 염색체 17p 결손 만성림프구성백혈병 환자
해당 연구는 제2상 단일군, 다기관, 오픈라벨 연구로 이전 치료 경험이 있는 염색체 17p 결손 만성 림프구 백혈병 환자 107명(주요 코호트)을 대상으로 벤클렉스타®정의 안전성과 유효성을 평가했다.
안전성 연장 코호트에는 환자 51명을 추가하며 평가했다. 환자들은 4~5주 동안 용량 조정 일정에 따라 1일 1회 20mg으로 시작해서 50mg, 100mg, 200mg, 최종적으로는 400mg까지 투여량을 증량했다. 환자들은 질환이 진행되거나 수용할 수 없는 독성이 관찰될 때까지 1일 400mg의 벤클렉스타®정을 투여 받았다.
평가 기간에 주요코호트의 치료기간중앙값은 23.1개월(0~44.2개월)이었으며, 통합코호트(주요코호트 및 안전성 연장 코호트, N=158)는 26.6개월(0~44.2개월)이었다. 주요코호트는 독립적인 심사위원회(independent review committee)에서 평가하였고, 통합코호트는 연구자들이 평가했다.
M14-032: B세포 수용체 억제제 치료에 실패한 만성 림프구성 백혈병 환자
해당 연구는 제2상 다기관, 오픈 라벨, 비무작위 배정 연구로 이브루티닙(이전 종양 치료 중앙값은 4 [범위 1~12])이나 이델라리십(이전 종양 치료 중앙값은 3[범위 1~11])의 치료에 실패한 경험이있는 만성 림프구성 백혈병 환자를 대상으로 벤클렉스타®정의 안전성과 유효성을 평가했다.
환자들은 최초 5주 동안 계획된 용량 조정 일정에 따라 벤클렉스타®정의 용량을 점진적으로 증가하여 투여 받았고, 질환이 진행되거나 수용할 수 없는 독성이 관찰될 때까지 벤클렉스타®정400mg을 1일 1회 지속적으로 투여 받았다. 데이터 확정시점에 주요 코호트인 환자 64명이 등록되어 벤클렉스타®정으로 치료받았다. 그 중 43명은 이브루티닙(A군), 21명은 이델라리십(B군)으로 이전에 치료한 경험이 있었다. A군 93%(39/42명)와 B군 67%(14/21명)가 이브루티닙 및 이델라리십 치료 이후 재발되거나 반응을 보이지 않았다.
염색체 이상은 염색체 11q 결손(30%, 19/62명), 염색체 17p 결손(36%, 23/61명), TP53 변이(26%, 16/61명), 변이되지 않은 IgVH (86%, 36/42명)가 있었다. 평가 당시 벤클렉스타®정 치료 기간 중앙값은 11.7개월(범위: 0.1~17.9개월)이었다.
벤클렉스타®정의 안전성은 두 개의 2상 임상과 한 개의 1상 임상에서 치료한 352명의 환자 데이터를 통해 알 수 있다.
해당 임상시험들에는 만성 림프구성 백혈병 치료 이력이 있는 환자들이 등록되었으며, 그 중 212명이 염색체 17p 결손이 있었고 148명이 이전에 B 세포수용체 경로저해제 치료를 받았지만 실패했다. 중대한 이상반응은 환자의 52%에서 보고되었고 질환의 진행과 관계없이 가장 자주 보고된 중대한 이상반응(≥5%)은 폐렴(9%), 열성 호중구감소증(5%)과 패혈증(5%)이었다. 9%의 환자가 질병의 진행과 관계없는 이상반응으로 시험 참여가 중단되었다.
이상반응으로 인해 환자의 13%는 투여량을 감소하였으며 36%는 일시적으로 투여를 중단했다. 용량 감소 또는 중단으로 이어진 가장 흔한 이상반응은 호중구감소증이었다(각각 5%).
벤클렉스타®정에 대하여
벤클렉스타®정은 BCL-2단백질에 선택적으로 결합하여 억제하는 기전의 최초 치료제다.
일부 혈액암에서 B세포림프종-2는 암세포가 자연사 혹은 자멸사하는 과정을 방지하는데, 이를 세포자멸사라고한다. 벤클렉스타®정은 B세포림프종-2 단백질을 타깃으로 하며 세포자멸사 과정을 회복하는데 도움을 준다.
벤클렉스타®정은 치료 5주차 1일 투여량 400mg까지의 증량 일정에 따라 투여해야 하며 1주차 1일 20mg, 2주차 50mg, 3주차 100mg, 4주차 200mg, 5주차 400mg까지 용량을 증량하여 복용한다. 이와같은 증량일정이 완료되면 1일 1회 400mg으로 용량을 유지한다.