시냅스 접착 단백질 PTPδ에 의한 시냅스 생성 및 수면 조절
Splice-dependent trans-synaptic PTPδ-IL1RAPL1 interaction regulates synapse formation and non-REM sleep.
수면을 조절하는 시냅스 분자기전이 밝혀졌다.
기초과학연구원(IBS, 원장 노도영) 시냅스 뇌질환 연구단 김은준 단장 연구팀은 신경전달의 기본 단위인 시냅스 생성과 수면 조절의 연관성을 규명했다.
이를 통해 수면 장애를 포함한 관련 뇌질환의 발병 기전에 대한 이해의 폭을 넓힐 것으로 기대된다.
뇌에 존재하는 수많은 신경세포는 시냅스(synapse)를 통해 신호를 주고받는다. 시냅스는 신경세포 간 혹은 신경세포와 다른 신경세포가 만나는 접합 부위로, 전시냅스(presynapse)와 후시냅스(postsynapse)로 구성되어있다. 전시냅스에서 나온 신경전달물질을 후시냅스의 신경전달물질 수용체가 감지하면 신경전달(synaptic transmission)이 일어난다. 각 시냅스는 신경회로가 정상적으로 작동하기 위한 뇌의 최소 구조단위이며, 위치와 기능 등 다양한 요소에 따라 고유의 성질을 가진다.
전시냅스와 후시냅스에는 시냅스 접착 단백질이 각각 존재한다. 시냅스 접착 단백질들은 서로 상호작용하며 악수하듯 만나 시냅스를 생성하는데, 이 때 서로 ‘코드’가 맞으면 두 신경세포가 연결되어 소통하는 것이 가능해진다. 그 동안 확인된 여러 종류의 시냅스 접착 단백질들과 달리, 각 단백질의 생체 내 기능에 대해서는 별로 알려진 바가 없었다.
연구팀은 전시냅스 접착 단백질인 PTPδ단백질 PTPδ단백질1)이 후시냅스 접착 단백질인 IL1RAPL1단백질2)과 상호작용하여 시냅스를 생성하고, 정상적인 수면이 이루어지도록 작동함을 밝혔다. 수면은 뇌가 정상적으로 작동하는 데 필수적인 요소이다. 생체리듬에 관여하는 유전자와 수면 간의 연관성은 보고된 바 있으나, 시냅스와 수면 간의 연관성은 아직 밝혀진 바가 없었다. 이번 연구로 시냅스 접착 단백질인 PTPδ단백질과 수면 간의 연관성이 규명된 것이다.
연구팀은 PTPδ단백질 전체가 결손된 생쥐 모델을 제작하고, 시냅스 생성, 신경전달과 동물 행동 등을 관찰하였다. PTPδ단백질 전체가 결손된 경우, 시냅스 생성이 감소하여 뇌 해마에서의 신경전달이 잘 이루어지지 않아 정상적인 수면 조절이 방해되었다. 또한 PTPδ단백질의 일부인 meA 스플라이스 펩타이드를 결손시킨 경우에도 PTPδ단백질 전체가 결손된 경우와 비슷한 수준으로 시냅스 생성이 감소되고 수면 장애가 유발되었다. 이는 meA 스플라이스 펩타이드가 PTPδ단백질과 IL1RAPL1단백질 간의 상호작용에 있어 중요한 요소임을 시사한다.
연구팀은 대부분의 신경뇌질환과 동반되는 수면장애 여부를 확인하기 위해 뇌파검사(Electroencephalogram, EEG)를 진행했다. 그 결과 흥분성 신경세포에서의 PTPδ단백질 전체가 결손된 생쥐와 PTPδ단백질의 일부인 meA 스플라이스 펩타이드가 결손된 생쥐에서 깊은 수면(non-REM)시 발생하는 뇌파가 감소되어 있음을 확인하였다. 이는 PTPδ단백질이 수면 조절뿐만 아니라 깊은 수면(non-REM)과도 밀접한 관련이 있음을 의미한다.
김은준 단장은 “PTPδ단백질이 시냅스 생성 및 정상적인 수면에 필수적인 시냅스 접착 단백질임을 밝혔다”며 “하지불안증후군3)과 같은 수면장애, 조현병4), 주의력결핍 과잉행동장애(ADHD)5) 등 관련 뇌질환의 발병 기전 이해와 진단 및 치료에 도움을 줄 것으로 예상된다”고 말했다.
연구결과는 세계적 학술지 엠보(EMBO, IF 11.24)에 4월 19일(한국시간)에 게재되었다.
[참조]
1) PTPδ단백질(Protein tyrosine phosphatase δ, 단백질 티로신 인산가수분해효소 델타) : 주로 시냅스에 위치하며 타깃 단백질의 티로신 잔기 의 탈인산화를 촉진하여 시냅스 생성을 촉진한다. 수면장애, 조현병, 주의력결핍 과잉행동장애(ADHD)와 관련이 깊다.
2) IL1RAPL1단백질 : 주로 시냅스에 위치하며 여러 시냅스 단백질들을 한군데 모아 서로 기능적으로 상호작용하게 한다.
하지불안증후군(restless leg syndrome, 유병율 5%) : 주로 잠들기 전에 다리가 저리는 등의 불쾌한 느낌이 들면서 숙면을 취하지 못하는 수면장애다.
3) 조현병(schizophrenia, 유병율 1%) : 망상, 환청, 와해된 언어, 정서적 둔마 등의 증상과 더불어 사회적 기능에 장애를 일으킬 수도 있는 정신 질환이다.
4) 주의력결핍 과잉행동장애(attention deficit / hyperactivity disorder, 유병율 5%) : 아동기에 주로 나타나는 장애로, 지속적으로 주의력이 부족하여 산만하고 과다활동, 충동성을 보이는 상태다.
연구 추가 설명
논문명
Splice-dependent trans-synaptic PTPδ-IL1RAPL1 interaction regulates synapse formation and non-REM sleep.
(EMBO, Apr 29, 2020)
저자정보
Haram Park*, Yeonsoo Choi*, Hwajin Jung*, Seoyeong Kim*, Suho Lee, Hyemin Han, Hanseul Kweon, Suwon Kang, Woong Seob Sim, Frank Koopmans, Esther Yang, Hyun Kim, August B. Smit, Yong Chul Bae, Eunjoon Kim (* contributed equally)
연구내용
보충설명
▷ PTPδ 단백질 꼬리 부위에 tdTomato라는 형광단백질이 융합된 퓨젼 단백질을 발현하는 생쥐를 만들어서, PTPδ이 생쥐의 뇌의 어떤 부위에서 발현되는지를 자세히 밝힘.
▷ PTPδ 단백질이 결손된 생쥐의 뇌의 해마에서 흥분성 시냅스의 숫자가 감소하고, 신경 전달이 감소함을 발견함.
▷ PTPδ 단백질 결손시킨 후, 단백질의 인산화 정도를 분석했을 때, PTPδ와 결합하는 것으로 알려져 있는 후시냅스 접착단백질인 IL1RAPL1의 인산화가 급격히 감소한 것을 관찰했다. 이는 PTPδ와 IL1RAPL1의 상호작용이 중요함을 암시.
▷ PTPδ 단백질에 mini-exon A (meA) 라고 불리는 9개 아미노산으로 이뤄진 짧은 펩타이드 (splice peptide insert)가 있는데 이를 통해 PTPδ가 IL1RAPL1과 결합한다. In vivo 상에서 meA만 삭제하여 PTPδ와 IL1RAPL1의 결합만 선택적으로 결손 시킨 생쥐를 만들었을 때 PTPδ 전체가 결손된 생쥐와 비슷하게 신경전달이 감소됨을 확인.
▷ 수면을 관찰했을 때 PTPδ 전체가 감소된 생쥐와 meA가 결손된 생쥐에서 비슷하게 수면 (특히 깊은 수면으로 알려져 있는 non-REM sleep; 델타 수면파가 특징임)이 감소함.
▷ PTPδ는 흥분성 신경세포와 억제성 신경세포 모두에 발현되어 있는데, 특히 흥분성 신경세포에 발현된 PTPδ가 수면조절에 중요함.
연구이야기
[연구배경]
시냅스 형성에 중요하다고 알려진 PTPδ가 시냅스 형성 및 발달 과정에서 어떠한 기능을 하는지, 있다면 PTPδ가 발현하는 시냅스들은 어떠한 행동학적 뇌신경 회로를 조절하는지를 조사하고자 연구를 시작하였다.
[연구과정]
PTPδ가 결손된 생쥐를 제작하였으며, 다양한 방법으로 시냅스 형성, 신경전달 및 동물 행동 등을 관찰하였다.
[연구결과]
PTPδ가 결손된 생쥐의 해마에서 PTPδ가 결손될 경우, 시냅스의 숫자와 신경 전달이 감소되었다.
또한, PTPδ가 결손될 경우 많은 단백질의 인산화 정도에도 큰 영향이 있었다. 특히 PTPδ와 상호작용하는 후시냅스 접착 단백질인 IL1RAPL1의 인산화 정도가 확연히 감소되어있었다.
흥미롭게도 IL1RAPL1에만 결합하는 PTPδ의 일부 단백질 (meA 펩타이드 포함)만 결손시킬 경우, PTPδ 전체를 결손 시킨 생쥐에서 보이는 신경전달의 감소가 비슷하게 관찰되었다.
임상적으로 PTPδ는 조현병 및 ADHD 등의 뇌정신질환 뿐만 아니라 인구의 5%가 겪고 있는 하지불안증후군 (sleepless leg syndrome)과 깊은 연관이 있음. 흥미롭게도, PTPδ 결손 생쥐에서 비슷한 수면장애가 있음을 발견했다. 이와 같은 수면 장애는 PTPδ의 meA만 결손된 생쥐에서도 똑같이 발견되었다.
[향후 연구계획]
본 논문은 주로 해마의 시냅스 및 신경전달 결손을 관찰하였고, 수면 조절과 관련이 있는 또 다른 뇌 영역인 대뇌피질을 분석하지는 않았다. 향후 연구에서는 해마에 이은 대뇌피질의 상세 분석을 계획하고 있다.
그림 설명
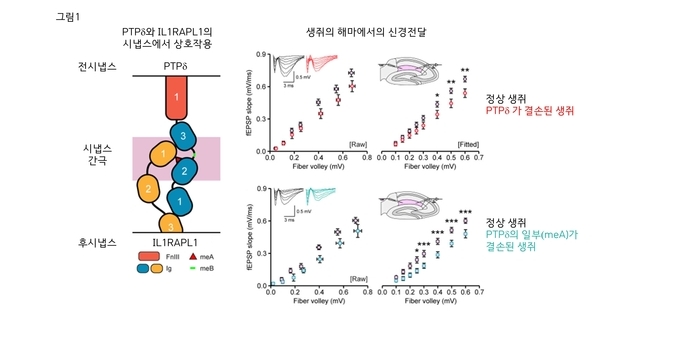
1) 왼쪽 그림
전시냅스(위쪽)의 PTPδ단백질과 후시냅스(아래쪽)의 IL1RAPL1단백질이 서로 상호작용함을 보여준다. meA 스플라이스 펩타이드(붉은삼각형)가 이 상호작용에 필수적이다.
2) 오른쪽 그림
PTPδ단백질 전체 또는 PTPδ단백질의 일부(meA 스플라이스 펩타이드)가 결손된 생쥐의 경우, 뇌 해마에서의 신경전달이 비슷한 수준으로 감소된다. 이는 meA 스플라이스 단백질을 매개로 이루어지는 PTPδ단백질과 IL1RAPL1단백질 사이의 시냅스 상호작용이 시냅스 생성 및 신경 전달에 중요함을 의미한다.
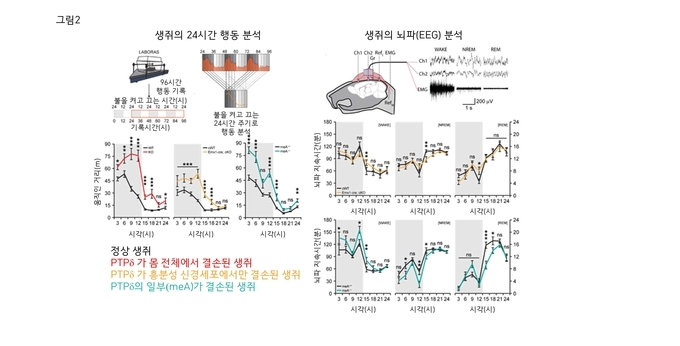
1) 왼쪽 그림
PTPδ단백질의 결손이 수면에 어떤 영향을 미치는지 알아보기 위해, 4일 동안 지속적으로 수면을 포함한 생쥐의 행동을 기록하고 24시간 단위로 끊어서 분석하였다. 24시간 중에서 처음 12시간(회색)은 불이 꺼진 상태인데 생쥐가 야행성이므로 움직임이 더 활발하다. 나중 12시간(흰색)은 불이 켜진 상태인데 생쥐는 이때 잠을 청한다. 정상 생쥐(wild type 또는 WT; 검은선으로 표시)에 비해 PTPδ단백질 결손 생쥐들이 불이 꺼진 상태에서 움직임이 활발하다는 것은 깨어 있는 상태에서 활동성이 높음을 의미하며(hyperactivity), 불이 켜진 상태에서 움직임이 활발하다는 것은 수면 시간이 줄어들어 있음을 의미한다. 이 실험에는 총 3종류의 생쥐가 사용되었다; PTPδ단백질 전체가 결손된 생쥐(붉은색), PTPδ단백질이 흥분성 신경세포에서만 결손된 생쥐(주황색), PTPδ단백질의 일부(meA 스플라이스 펩타이드)만 결손된 생쥐(파란색). 흥미롭게도 3종류의 생쥐 모두에서 비슷한 형태의 수면장애가 관찰되었다.
2) 오른쪽 그림
많은 신경뇌질환에 동반되는 수면장애 여부를 확인하기 위하여 뇌파검사 (Electroencephalogram, EEG)를 진행하고 깨어 있을 때의 뇌파(WAKE) 및 두 가지 종류의 수면 뇌파(깊은 수면 관련 non-REM 뇌파, 꿈 관련 REM 뇌파)들을 관찰하였다. 그 결과 두 종류의 PTPδ단백질 결손 생쥐(흥분성 신경세포에서의 PTPδ단백질 결손 생쥐[주황색], PTPδ단백질의 일부인 meA 스플라이스 펩타이드 결손 생쥐[파란색]) 모두에서 깊은 수면 관련 non-REM 뇌파가 감소되어 있음을 발견하였다. 꿈 관련 REM 뇌파는 두 생쥐에서 서로 다르게 변화하였다. 이 결과들은 PTPδ단백질이 수면 조절뿐만 아니라 깊은 수면 관련 non-REM 뇌파와도 밀접한 관련이 있음을 의미한다.
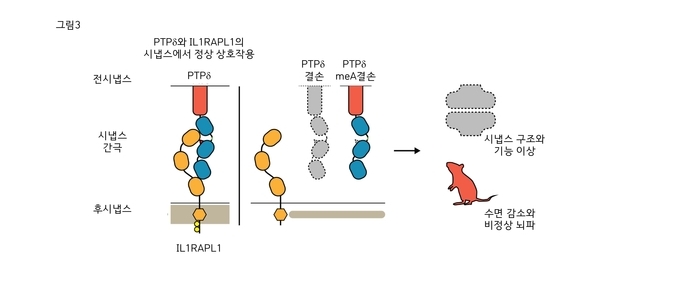
이번 연구로 전시냅스의 PTPδ단백질과 후시냅스의 IL1RAPL1단백질이 서로 결합하며, 이 상호작용이 PTPδ단백질의 전체 또는 일부(meA 스플라이스 펩타이드) 결손을 통해 억제되면, 시냅스 생성이 감소하고 정상적인 수면 조절이 방해되며 수면 뇌파가 감소함을 밝혔다. PTPδ단백질이 하지불안증후군, 조현병, ADHD 등과 깊은 연관이 있는 만큼 향후 관련 뇌질환의 발병원인 이해, 진단 및 치료에 도움이 될 것으로 보인다.
연구진 이력사항
[김은준 IBS 시냅스 뇌질환 연구단장, 교신저자]
1. 인적사항
· 소속 : IBS 시냅스 뇌질환 연구단 및 카이스트 생명과학과
· 전화 : 042-861-2630
· 이메일 : kime@kaist.ac.kr
2. 학력
Ph.D. 1994, Michigan State University 약물학 박사
M.S. 1988, KAIST 생물학 석사
B.S. 1986, 부산대학교 약학 학사
3. 경력사항
1988 - 1991 생명공학연구소 연구원
1995 - 1996 Harvard Univ 박사후연구원
1997 - 2000 부산대학교 약학과 전임강사/조교수
2000 - 현재 KAIST 생명과학과 조교수/부교수/교수
2012 - 현재 IBS 시냅스 뇌질환 연구단 연구단장
2010 - 현재 한국과학기술한림원 정회원
[박하람, IBS Postdoc 연구원, 공동 제 1저자]
1. 인적사항
· 소속 : IBS 시냅스 뇌질환 연구단
· 이메일 : haram9071@gmail.com
2. 학력
Ph.D. 2019, 한국과학기술원, 생명과학 박사
B.S. 2013, 한국과학기술원, 생명과학
3. 경력사항
2019.3 - 2019.9 IBS 시냅스 뇌질환 연구단 박사후연구원
2019.10 - 현재 Oxford Univ 박사후연구원
[최연수, IBS Postdoc 연구원, 공동 제 1저자]
1. 인적사항
· 소속 : IBS 시냅스 뇌질환 연구단
· 이메일 : yeonsoo.korea@gmail.com
2. 학력
Ph.D. 2019, 한국과학기술원, 생명과학 박사
B.S. 2013, 한국과학기술원, 생명과학
3. 경력사항
2019.3 - 2019.10 IBS 시냅스 뇌질환 연구단 박사후연구원
2020 - 현재 Oxford Univ 박사후연구원
[정화진, IBS 연구위원, 공동 제 1저자]
1. 인적사항
· 소속 : IBS 시냅스 뇌질환 연구단
· 전화 : 042-350-2673
· 이메일 : junghgm@gmail.com
2. 학력
Ph.D. 2012, 서울시립대학교 생명과학 박사
M.S. 2008, 서울시립대학교 생명과학 석사
B.S. 2006, 서울시립대학교 생명과학 학사
3. 경력사항
2012 - 2013 서울시립대학교 생명과학과 연구교수
2013 - 2018 IBS 시냅스 뇌질환 연구단 연구위원 (비영년 트랙)
2018 - 현재 IBS 시냅스 뇌질환 연구단 연구위원 (영년 트랙)
[김서영, 한국과학기술원 박사과정, 공동 제 1저자]
1. 인적사항
· 소속 : 한국과학기술원 생명과학과
· 전화 : 042-350-2673
· 이메일 : kimseoyeong@kaist.ac.kr
2. 학력
B.S. 2019, 한국과학기술원, 생명과학
3. 경력사항
2019 - 현재 한국과학기술원 생명과학과, 석박사통합과정
[자료 도표 사진 기초과학연구원 제공]