한국노바티스(대표: 조쉬 베누고팔)는 전이성 유방암치료제 키스칼리(리보시클립)의 전체생존기간 (Overall Survival, OS) 개선 효과를 입증하는 새로운 연구 결과가 5월 29일부터 열리는 2020미국종양학회(이하 ASCO) 온라인 학술대회에서 소개 될 예정이라고 밝혔다.
이번 결과는 키스칼리의 제 3상 임상연구인 MONALEESA-7과 MONALEESA-3의 서브그룹 분석을 통해 도출됐다.
이번 서브그룹 분석 결과에서 키스칼리+내분비요법 병용은 내분비요법 단독요법과 비교하여 호르몬수용체 (HR) 양성, 인간상피세포성장인자수용체2 (HER2) 음성(HR+/HER2-)인 내장 전이를 동반한 진행성 또는 전이성 유방암 환자에서 전체생존기간을 개선하는 것으로 나타났으며, 이는 전체 참여 환자에게서 나타난 임상적 효과와 일치한다.
본 임상연구의 책임연구원인 사라 캐논 연구소(Sarah Cannon Research Institute)의 데니스 야들리(Denise Yardley) 박사는 “2건의 3상 임상을 함께 분석한 이번 결과는 폐경 상태나 전이 위치에 관계없이 1차 치료에서 키스칼리를 처방할 수 있음을 보여준다”며, “내장전이가 있는 환자는 보통 예후가 더 좋지 않으며 치료 내성 위험이 더 크기 때문에 해당 환자군에서 키스칼리 병용요법이 보여준 일관된 전체생존개선 효과는 매우 유의미하다”고 밝혔다.
MONALEESA 임상은 키스칼리를 폐경 전 여성에서 비스테로이드 아로마타아제 억제제(NSAI)+고세렐린과 병용(MONALEESA-7), 폐경 후 여성에서 풀베스트란트와 병용(MONALEESA-3)하여 평가한 연구로, 참가자의 약 60%에서 내장전이(내장전이 위기[visceral crisis] 제외)가 있었는데 이는 리얼월드 임상 현장 데이터를 반영한다. MONALEESA-7 임상에서 키스칼리+내분비요법은 해당 환자군 대상 사망위험을 30% 감소시켰으며 (OS 중앙값 도달하지 않음 [NE] vs. NSAI+고세렐린의 39.9개월: HR= 0.698 [95% CI: 0.462-1.054]), MONALEESA-3에서는 사망위험을 20% 감소시켰다 (OS 중앙값 41.0개월 vs. 풀베스트란트 39.4개월: HR=0.804 [95% CI: 0.596-1.083]).
간 전이가 있는 환자의 경우 MONALEESA-7 임상에서 키스칼리 병용요법은 사망위험 47% 감소시켰으며 (OS 중앙값 도달하지 않음 [NE] vs. NSAI+고세렐린의 33.6개월: HR=0.531 [95% CI: 0.321-0.877]), MONALEESA-3에서는 사망위험 37% 감소시켰다 (OS 중앙값 36.1개월 vs. 풀베스트란트의 24.1개월: HR=0.629 [95%CI: 0.421-0.942]). 이상반응은 전체 환자군에서 일관적으로 나타났다.
노바티스 항암제 사업부 대표 수잔느 샤퍼트(Susanne Schaffert) 박사는 “키스칼리의 우월한 전체생존기간 개선 효과는 2건의 3상 임상에서 입증되었으며 이번 서브그룹 분석은 키스칼리가 가장 공격적인 진행성 유방암에서도 환자의 생존에 혜택을 줄 수 있음을 시사한다”면서 “노바티스는 우리가 하는 모든 업무에서 항상 환자를 위하는 길을 찾고 있으며, 암 환자가 더 오래, 더 잘 살 수 있다는 희망을 가지고 또 다른 미래를 꿈꿀 수 있도록 암치료의 혁신적인 발전을 위해 계속 노력하겠다”고 밝혔다.
ASCO20 온라인 학술대회에서 발표되는 키스칼리 관련 추가 데이터는 아래와 같다.
• 진행성 유방암에서 신호전달경로 및 암 관련 약 550개의 유전자로 구성된 표적패널을 통해 최대규모의 CDK4/6 억제제의 통합(pooled) 바이오마커 데이터세트 구두 발표. 본 분석을 통해 세 건의 MONALEESA 임상 모두에서 주요한 잠재적 유전자 변형과 키스칼리 반응 또는 내성과의 관련성을 파악할 수 있다.
• 환자 3,246명 대상 1차 치료에서 키스칼리+레트로졸 병용을 평가하기 위해 리얼월드 임상 현장과 매우 유사한 다양하고 폭넓은 환자로 구성된 3b상 단일군 임상 CompLEEment-1의 결과 업데이트. 본 결과는 질병진행까지의 기간 중앙값 27.1개월 (95% CI: 25.7- OS 중앙값 도달하지 않음 [NE]), 전체반응비율 43.6% (95% CI: 41.5-45.8%) 등 MONALEESA 임상과 일치하였다. 가장 흔한 이상반응은 호중구 감소증, 메스꺼움, 피로였으며, 임상 진행 환자의 12.9%는 치료관련 이상반응으로 임상을 중단하였다.
• CDK4/6 억제제 치료 후 가장 흔한 이상반응인 호중구 감소증의 경제적 부담을 평가하는 리얼월드 데이터를 활용한 후향 연구 결과. 팔보시클립 치료군 가운데 38명(25%), 키스칼리 치료군 가운데 25명(17%)에서 호중구 감소증이 보고되었다. 호중구 감소증 1/2등급과 4등급은 유사한 비율로 나타났으나 3등급의 경우 수치 상 차이가 있었다 (팔보시클립 35% vs. 키스칼리 26%).
키스칼리는 전 세계 75개국 이상에서 승인받았으며, 2020년 3월 국내 출시됐다. MONALEESA-7 및 MONALLES-3 등 2 건의 3상 임상에서 통계적으로 유의미한 전체생존기간 연장의 임상적 혜택을 보여줬다. ,
키스칼리TM (리보시클립)에 대하여
키스칼리는 내분비요법 단독요법과 비교하여 일관적이고 지속적인 효능을 보여준 최대 규모의 1차 치료 임상연구 결과를 보유한 CDK4/6 억제제이다. MONALEESA-7 및 MONALEESA-3 임상의 전체생존 결과는 각각 2019 ASCO 학술대회와 2019 유럽종양학회(ESMO) 학술대회에서 발표되었는데, 키스칼리+내분비요법이 폐경 전, 폐경 이행기 또는 폐경 후 HR+/HER2- 진행성 유방암 여성 환자에서 유의미하게 수명을 연장해주는 것으로 나타났다. 3상 MONALEESA-2 임상의 전체생존 추적조사는 현재 진행 중이다.
키스칼리는 중추적 MONALEESA-2 임상 결과를 바탕으로 2017년 3월 미 FDA, 2017년 8월 유럽연합으로부터 폐경 후 여성에서 HR+/HER2- 국소 진행성 또는 전이성 유방암 치료를 위해 아로마타제 억제제와 병용하는 1차 내분비 기반요법으로 최초 승인을 받았다. 키스칼리와 아로마타제 억제제 병용은 폐경 전, 폐경 이행기 또는 폐경 후 여성에서 1차 내분비 기반요법으로 승인받았으며, 풀베스트란트와 병용하는 요법으로 폐경 후 여성에서 1차 또는 2차 치료제로 2018년 7월 FDA로부터, 2018년 12월 유럽연합으로부터 적응증을 받았다. 현재 전 세계 기타 보건당국에 허가 신청 진행 중이다.
노바티스는 초기 유방암에서 키스칼리 연구를 통해 미래 암 치료의 지형을 바꾸고자 노력하고 있다. NATALEE연구는 HR+/HER2- 초기 유방암에서 보조요법으로 내분비요법을 병용하는 키스칼리를 평가하는 3상 임상으로, 종양중개연구소(Translational Research In Oncology, TRIO)와 함께 진행 중이다.
키스칼리는 노바티스 생명의학연구소(Novartis Institutes for BioMedical Research, NIBR)가 아스텍스 파마슈티컬스(Astex Pharmaceuticals)와 연구협약을 통해 개발하였다.
진행성 유방암과 노바티스
노바티스는 뛰어난 기술력과 협업, 그리고 환자 치료 혁신을 위한 열정을 무기로 유방암과 싸우고 있다. 임상연구에서 자주 배제되는 환자군을 연구에 포함시키고 질병 진행에 역할을 담당할 수 있는 새로운 경로 또는 변이 파악, 그리고 환자의 삶의 질을 단순히 유지시키는 것이 아니라 더 향상시켜주는 치료법 개발 등을 통해 대담한 연구개발 전략을 취하고 있다.
지난 30년 동안, 그리고 지금도 역시 노바티스의 최우선순위는 진행성 유방암 진단 환자의 삶의 질 향상과 수명 연장에 효과적이라고 증명된 치료제 제공이다.
적응증
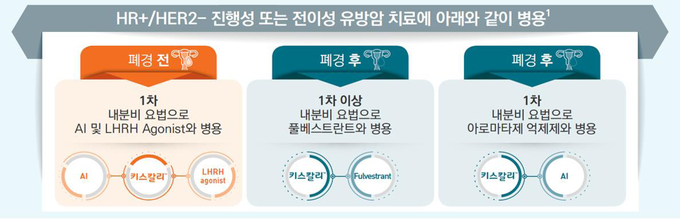
키스칼리TM(리보시클립)는 폐경 전, 폐경 이행기 또는 폐경 후 여성에서 호르몬수용체 (HR) 양성, 인간상피세포성장인자수용체2 (HER2) 음성 (HR+/HER2-) 진행성 또는 전이성 유방암 치료를 위해 1차 내분비 기반요법으로 아로마타제 억제제와 병용하거나, 폐경 후 여성에서 HR+/HER2- 진행성 또는 전이성 유방암 치료를 위해 1차 내분비 기반요법으로 혹은 내분비요법 후 질병 시 풀베스트란트와 병용하는 전문의약품이다.
중요 안전성 정보
키스칼리는 중증의 또는 생명을 위협하는 폐의 염증을 유발할 수 있다. 환자는 호흡기 증상이나 흉통이 있는 경우 이를 즉시 의료진에게 알려야 한다. 키스칼리는 QT 간격 연장이라고 알려진 심장질환을 유발할 수 있다. 이는 심장박동에 이상을 초래할 수 있으며 사망에 이르게 할 수 있다. 키스칼리는 QT 간격 연장 위험 증가로 인해 타목시펜과 동시치료로 승인되지 않았다. 환자는 심장박동에 변화(빠른 박동, 불규칙한 박동)가 있는 경우 또는 어지러움이나 현기증을 느끼는 경우 이를 즉시 의료진에게 알려야 한다. 키스칼리는 간에 심각한 이상을 초래할 수 있다. 환자는 다음과 같은 간장애 조짐이나 증상이 하나라도 있는 경우 이를 즉시 의료진에게 알려야 한다. 피부 또는 눈동자 흰자의 황변 (황달), 짙은 또는 갈색 (진한 차 색의) 소변, 극심한 피로, 식욕 부진, 우상복부 통증, 평소보다 쉽게 멍이 들거나 출혈 발생. 키스칼리 치료 시 백혈구 감소는 매우 흔하게 발생하며 중증의 염증으로 이어질 수 있다. 환자는 발열이나 오한과 같이 백혈구 감소 또는 염증의 조짐이나 증상이 있는 경우 이를 즉시 의료진에게 알려야 한다.
키스칼리가 태아에 유해한 영향을 미칠 수 있기 때문에 환자는 키스칼리 투약 전 임신 여부 또는 임신 계획이 있는지 의료진에게 알려야 한다. 가임 여성이 키스칼리 투약 시 치료 기간 동안 그리고 마지막 용량 투여 후 최소 3 주 동안 효과적인 피임법을 사용해야 한다. 키스칼리 치료 기간 동안 그리고 마지막 용량 투여 후 최소 3 주 동안 모유수유를 해선 안 된다.
환자는 키스칼리와 약물 상호작용이 발생할 수 있으므로 전문의약품, 일반의약품, 비타민제, 생약건강기능식품 등 복용하는 모든 의약품에 대한 정보를 의료진에 제공해야 한다. 환자는 키스칼리 투약 기간 동안 자몽이나 자몽주스 섭취를 피해야 한다.
가장 흔한 부작용(발생률 20% 이상)은 백혈구 감소, 메스꺼움, 염증, 피로, 설사, 구토, 탈모, 두통, 변비, 발진, 기침 등이 있다. 가장 흔한 3/4 등급의 부작용(발생률 5% 초과)은 호중구 감소, 백혈구 감소, 간기능 검사 이상, 림프구 감소 등이 있었다. 혈액학적, 임상화학적 검사에서 비정상적 수치가 나타났다.
키스칼리의 처방정보 일체는 www.kisqali.com에서 확인할 수 있다.
노바티스(Novartis)에 대하여
노바티스는 인류의 생명 연장과 삶의 질 개선을 목표로 의약품 혁신에 매진하는 세계적인 제약 기업이다.
업계를 선도하는 노바티스는 최첨단 과학기술과 디지털 기술을 접목하여 사회와 환자가 필요로 하는 혁신적인 의약품 개발에 앞장서고 있으며, 매년 세계에서 R&D에 가장 많은 투자를 하는 기업 순위에 이름을 올리고 있다. 노바티스의 의약품으로 치료받는 인구는 전 세계적으로 약 10억여명에 달하며 최신 의약품에 대한 환자 접근성을 높이는 혁신적인 방안들을 도입하고자 하는 노바티스의 노력은 현재도 계속되고 있다. 전 세계 각지에서 140여개 국가 출신 125,000명의 노바티스 임직원들이 근무하고 있다. 보다 자세한 내용은 www.novartis.com에서 확인할 수 있다.
한국노바티스(Novartis Korea)에 대하여
세계적인 제약•바이오기업, 노바티스의 자회사인 한국노바티스(www.novartis.co.kr)는 계열사인 한국산도스를 포함해 약 580여 명의 직원을 두고 있다.
한국노바티스는 지난 10년 간 한국에서만 약 200 여 건의 임상시험을 진행하여 국내 연구진과의 협력을 활발히 진행하고 있으며, 환우 및 가족 정서 지원 프로그램인 ‘치유(CHEER YOU)’, 환우의 사회 복귀 지원 프로그램 ‘이음’, 여성 암환자 지원 프로그램인 ‘가화맘사성’과 매년 전 직원이 자원봉사활동에 참여하는 ‘지역 봉사의 날’ 행사 등 다채로운 사회공헌활동을 통해 지역 사회에 이바지하는 기업이 되기 위해 최선을 다하고 있다.
References
1 Yardley, Denise, A. et. al. Overall survival (OS) in patients (pts) with advanced breast cancer (ABC) with visceral metastases (mets), including those with liver mets, treated with ribociclib (RIB) plus endocrine therapy (ET) in the MONALEESA (ML) -3 and -7 trials. Presented at the American Society of Clinical Oncology (ASCO) meeting (Abstract #1054).
2 Andre, Fabrice, et al., Pooled ctDNA analysis of the MONALEESA (ML) Phase III advanced breast cancer (ABC) trials. Presented at the American Society of Clinical Oncology (ASCO) meeting (Abstract #1009).
3 De Laurentiis, Michael, et. al. Updated Results From the Phase IIIb CompLEEment-1 Study of Ribociclib (RIB) Plus Letrozole (LET) in the Treatment of HR+, HER2– Advanced Breast Cancer (ABC). Presented at the American Society of Clinical Oncology (ASCO) meeting (Abstract #1055).
4 Schwartzberg, Lee et al. Real-world incidence, duration, and severity of treatment-emergent (TE) neutropenia among patients (pts) with metastatic breast cancer (MBC) treated with ribociclib (RIB) or palbociclib (PAL).
5 Slamon DJ, et al. Ribociclib (RIB) + fulvestrant (FUL) in postmenopausal women with hormone receptor-positive (HR+), HER2-negative (HER2-) advanced breast cancer (ABC): Results from MONALEESA-3. Journal of Clinical Oncology 2018.
6 Tripathy D, Sohn J, Im S, et al. First-line ribociclib or placebo combined with goserelin and tamoxifen or a non-steroidal aromatase inhibitor in premenopausal women with hormone receptor-positive, HER2-negative advanced breast cancer: results from the randomized Phase III MONALEESA-7 trial. Presented at the San Antonio Breast Cancer Symposium (SABCS), December 6, 2017, (Abstract #S2-05).