•빈다맥스®, 정상형 또는 유전성 트랜스티레틴 아밀로이드 심근병증(ATTR-CM) 성인 환자 치료를 위한 국내 허가 받은 최초이자 유일한 치료 옵션1,[2]
•ATTR-ACT 임상시험 결과 위약 대비 모든 원인에 의한 사망률과 심혈관 관련 입원 빈도 위험률 감소[3]
한국화이자제약(대표이사 사장 오동욱, www.pfizer.co.kr)은 정상형(wild-type) 또는 유전성(hereditary) 트랜스티레틴 아밀로이드 심근병증(Transthyretin Amyloid Cardiomyopathy, 이하 ATTR-CM) 치료제 ‘빈다맥스®캡슐 61mg’(Vyndamax, 성분명 : tafamidis, 타파미디스)가 8월 19일 식품의약품안전처로부터 성인 환자의 심혈관계 사망률 및 심혈관계 관련 입원의 감소에 대해 허가를 받았다고 밝혔다.1
빈다맥스®는 정상형 또는 유전성 ATTR-CM 성인 환자의 치료를 위해 허가 받은 최초이자 유일한 치료제로, 1일 1회 1캡슐 복용하는 제제다.1,2
ATTR-CM은 혈액 내에서 자연적으로 순환하는 운반 단백질인 트랜스티레틴(TTR)이 불안정해지며 잘못 접힌 단위체로 분리돼 심장에 쌓여 제한성 심근증을 일으키는 치명적인 진행성 희귀질환(rare, debilitating, and fatal disease)이다.[4],[5] 트랜스티레틴 유전자 돌연변이에 의해 발생하는 유전성과 돌연변이는 없지만 노화로 인해 발생하는 정상형으로 구분된다.[6],[7] 빈다맥스®는 트랜스티레틴 선택적 안정제로, 비정상적이고 불안정한 트랜스티레틴 단백질을 안정화시키고 분열을 방지해 환자 체내 아밀로이드 축적을 지연시킨다.[8]
ATTR-CM 환자들은 아밀로이드의 축적으로 인해 급속도로 예후가 악화될 수 있으며, 진단을 받은 시점으로부터 ATTR-CM 환자들의 생존기간의 중앙값은 약 2~3.5년에 불과하다.[9],[10],[11] ATTR-CM의 주요 증상으로는 울혈성 심부전과 관련된 체액 저류, 부종, 호흡 곤란, 피로, 우울증 등이 있으며, 이러한 증상들은 환자들의 신체적 기능과 삶의 질을 현저히 저하시킬 뿐만 아니라 제한성 심근증, 심부전, 또는 부정맥을 일으킨다.5,[12],[13],[14]
ATTR-CM은 오진 비율이 높고 진단이 지연되고 있으며, 유전형의 경우 지리학적으로 다양하기 때문에 정확한 유병률을 파악하기 어렵다.4,[15] 현재까지 약 120 종류 이상의 유전자 돌연변이가 알려져 있으며, 이 가운데 일부 유전 형태는 특정 지역의 풍토병 성격을 띄고 있는 것으로 알려져 있다.4,15 ATTR-CM의 주요 유전자 돌연변이 유형으로 알려진 Val122Ile 변이의 경우, 아프리카인 또는 아프리카계 카리브해인에만 영향을 미치며 인구의 3-4%에서만 나타난다는 보고가 있다.4 정상형 ATTR-CM 환자는 60세 이상 박출량 보존 심부전(HFpEF) 환자의 약 11%에서 아밀로이드 침착이 확인됐다는 연구 결과를 바탕으로 환자수를 추정하는 것 정도가 가능하다.[16] 이처럼 정확한 유병률을 확인하기 어려운 만큼, ATTR-CM 환자를 적절하게 관리하고 치료 결과를 개선하기 위해서는 정확한 조기 진단이 무엇보다 중요한 요소다.9,15
이번 허가는 441명의 ATTR-CM 환자를 대상으로 진행된 다기관, 국제, 이중맹검, 위약대조, 제3상 임상연구인 ATTR-ACT 연구를 기반으로 이루어졌다.3 ATTR-ACT 연구에서 441명의 환자들은 2:1:2의 비율로 타파미디스 80mg, 타파미디스 20mg, 위약 투여군에 각각 무작위 배정되었으며, 연구의 1차 평가 변수로 모든 원인에 의한 사망과 심혈관 관련 입원 빈도를 계층적으로 평가했다.3 연구의 주요 2차 평가변수는 기저시점 대비 30개월 시점까지의 6분 보행검사(6-minute walk test)와 점수가 높을수록 더 나은 건강 상태를 의미하는 ‘캔자스 대학 심근병증 설문지(Kansas City Cardiomyopathy Questionnaire-Overall Summary, KCCQ-OS)’ 점수의 변화였다.3
연구 결과, 타파미디스 투여군(n=264)은 위약 투여군(n=177) 대비 모든 원인에 의한 사망 (78 of 264 [29.5%] vs. 76 of 177 [42.9%]; HR, 0.70; 95% CI, 0.51 to 0.96) 및 심혈관 관련 입원 위험률 (0.48 per year vs. 0.70 per year; RRR 0.68; 95% CI, 0.56 to 0.81)이 통계적으로 유의하게 더 낮은 것으로 나타났다.3 또한, 연구 30개월 시점에서 환자의 기능적 운동능력을 측정하는 6분 보행검사 및 환자의 삶의 질을 평가하는 ‘캔자스 대학 심근병증 설문지’ 점수의 감소폭을 낮춘 것으로 나타났다 (각각 p<0.001).3 위약 대비 유의미한 차이는 연구 6개월 시점에 처음 관찰됐다.3
한국화이자제약 희귀질환사업부 대표 조연진 상무는 “ATTR-CM 치료 분야의 혁신신약인 빈다맥스®의 이번 허가를 통해 심장 및 간 이식 외에는 이렇다 할 치료법이 없었던 ATTR-CM 치료의 새로운 장을 열게 되어 기쁘게 생각한다”며 “빈다맥스®의 국내 허가는 희귀질환 환자들에게 혁신적인 치료제를 공급하기 위한 화이자의 지속적인 노력의 결과로, 한국화이자제약은 앞으로도 국내 ATTR-CM 치료 환경 개선을 위해 최선의 노력을 다할 것”이라고 말했다.
한편, 빈다맥스®는 2019년 미국에 이어 2020년 캐나다, 유럽 내에서 ATTR-CM 치료제로 허가 받았으며, 미국, 유럽 내에서는 희귀의약품으로 지정된 바 있다.8,[17],[18],[19],[20]
ATTR-CM에 대하여
트랜스티레틴 아밀로이드 심근병증(ATTR-CM)은 치명적인 진행성 희귀질환으로, 4개의 동일한 테트라머로 구성된 운반단백질인 트랜스티레틴의 불안정으로 인해 야기된다.3,5, 불안정한 트랜스티레틴테트라머가 서로 분리되면 잘못 접혀진 단백질이 되며 이로 인해 형성된 아밀로이드피브릴이 심장에 축적된다.3,5
해당 단백질은 심장에 쌓여 제한성심근증, 심부전 등을 초래한다.3,5 ATTR-CM에는 두가지 아형이 있다.7 유전성 ATTR-CM은 변이성 ATTR-CM으로도 알려져 있는데, 트랜스티레틴 유전자변이로 인해 야기되며 빠르게는 45세부터 나타날 수 있다. 유전자변이 없이, 노화로 인해 나타나는 정상형 ATTR-CM이 더 흔한 유형이며 보통 65세 이상 남성에게서 관찰된다.4, ATTR-CM은 진단이 어렵고 오진비율이 높다.9 ATTR-CM환자의 기대수명은 2~3.5년이며 아형에 따라 다소 차이가 있다.10,11
빈다맥스®(성분명: 타파미디스)
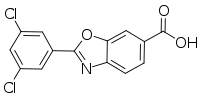
빈다맥스®(성분명: 타파미디스)는 경구형 트랜스티레틴 안정제로서, 트랜스티레틴에 선별적으로 결합하여 트랜스티레틴 운반단백질의 테트라머를 안정시키고, ATTR-CM을 야기하는 아밀로이드 형성을 늦춘다.8
빈다맥스®는 1일 1회 복용하는 61mg 캡슐형 경구제다.2
References
[3] Mathew S, et al. Tafamidis Treatment for Patients with Transthyretin Amyloid Cardiomyopathy. N Engl J Med. 2018;379:1007-16
[4] Maurer MS, Elliott P, Comenzo R, Semigran M, Rapezzi C. Addressing Common Questions Encountered in the Diagnosis and Management of Cardiac Amyloidosis. Circulation. Apr 4 2017;135(14):1357-1377.
[5] Grogan M, Dispenzeri A, Carlsson M, Schumacher J, Stewart M. Description of the Health-Related Quality of Life of Transthyretin Amyloid Cardiomyopathy Subjects From the Transthyretin amyloidosis Outcomes Survey [ABSTRACT]. 21st Annual Meeting of the Heart Failure Society of America (HFSA); September 16-19, 2017; Grapewine, TX.
[6] Mohty D, Damy T, Cosnay P, et al. Cardiac amyloidosis: updates in diagnosis and management. Arch Cardiovasc Dis. Oct 2013;106(10):528-540.
[7] Rapezzi C, Quarta CC, Riva L, et al. Transthyretin related amyloidoses and the heart: a clinical overview. Nat Rev Cardiol. 2010;7:398-408.
[8] Pfizer. HIGHLIGHTS OF PRESCRIBING INFORMATION: Vyndaqel & Vyndamax. As of 28 May. 2019.
[9] Witteles RM, Bokhari S, Damy T, et al. Screening for Transthyretin Amyloid Cardiomyopathy in Everyday Practice. JACC Heart Fail. 2019 Aug;7(8):709-716.
[10] Grogan M, Scott CG, Kyle RA, et al. Natural history of wild-type transthyretin cardiac amyloidosis and risk stratification using a novel staging system. Heart Fail Rev. 2015 March; 20(2): 163–178.
[11] Connors LH, Sam F, Skinner M, et al. Heart failure due to age-related cardiac amyloid disease associated with wild-type transthyretin: a prospective, observational cohort study. Circulation. 2016;133(3):282-290.
[12] Park GY, Jamerlan A, Shim KH, An SSA. Diagnostic and Treatment Approaches Involving Transthyretin in Amyloidogenic Diseases. Int J Mol Sci. 2019;20(12):2982.
[13] Rohyans LM, Pressler SJ. Depressive symptoms and heart failure: examining the sociodemographic variables. Clin Nurse Spec. 2009;23(3):138-144.
[15] González-López E, et al. Diagnosis and Treatment of Transthyretin Cardiac Amyloidosis. Progress and Hope. Rev Esp Cardiol 2017;70:991–1004.
[16] Mohammed SF, Mirzoyev S, Edwards W et al. Left ventricular amyloid deposition in patients with heart failure and preserved ejection fraction. JACC Heart Fail 2014;2(2):113-122.
[17] CADTH. CADTH Webpage>About CADTH>What We Do>Programs and Services>CADTH Common Drug Review>Reports>tafamidis. https://cadth.ca/tafamidis As of 8 Apr. 2020. Accessed on 14 Aug. 2020 [18] EMA. Summary of Product Characteristics. Vyndaqel 61 mg soft capsules. As of 21 Feb. 2020.
[19] FDA. ADMINISTRATIVE and CORRESPONDENCE DOCUMENTS. As of 13 Jun. 2019.
[20] EMA. Orphan Maintenance Assessment Report: Vyndaqel(tafamidis). As of 25 Feb. 2020.