0, 2주 2회 300mg 정맥 주입 후, 반응성 보이는 환자에게 108mg 피하 주입 가능
정맥주사와 동일한 환자군에 피하주사 치료옵션까지 제공하며 투여 편의성 개선
한국다케다제약(대표 문희석)은 자사의 크론병∙ 궤양성대장염 치료제 킨텔레스(성분명 베돌리주맙) 프리필드펜주(이하 킨텔레스 피하주사)가 2월 17일자로 식품의약품안전처의 시판 허가를 받았다고 밝혔다.
킨텔레스는 크론병 및 궤양성대장염 치료 분야의 유일한 항인테그린제제로, 그동안 국내에서는 환자들이 병원을 방문해 투여하는 정맥주사(IV, intravenous injection) 제형으로 사용되어 왔다. 정맥주사 1회 투여 시간이 30분으로 짧은 킨텔레스가2 환자 스스로 투여할 수 있는 피하주사제(SC, subcutaneous injection)까지 추가로 허가 받은 만큼, 환자들의 치료 편의성을 한층 더 향상시킬 것으로 기대 되고 있다. 킨텔레스 피하주사는 해외에서 먼저 승인되어 2020년부터 유럽, 캐나다, 오스트레일리아 등 주요 시장에서 활발히 사용되고 있다.
한국다케다제약 김태훈 소화기사업부 총괄은 “염증성장질환은 젊은 나이에 발병해 증상이 만성적으로 지속되는 질환이기 때문에 꾸준한 관리를 위한 치료 순응도가 무엇보다 중요하다”며 “많은 염증성장질환 치료제가 단일 제형인 점을 감안할 때, 장에만 작용하는 킨텔레스의 치료 옵션을 정맥주사 및 피하주사 모두로 제공하며1,2 환자 치료 편의성을 개선시킬 수 있어 기쁘게 생각한다”고 소감을 밝혔다.
킨텔레스 피하주사제는 정맥주사제와 동일하게 중증도에서 중증의 활성 크론병 및 궤양성대장염의 치료에서 사용된다. 투여 방법은 킨텔레스주 300mg을 제0주, 제2주에 정맥 주입하고, 투여 후 6주가 되는 시점에 반응성을 보이는 환자에게는 6주차부터 매 2주마다 108mg을 피하 주입한다.1
▲궤양성대장염에서 정맥주사제와 일치하는 우수한 치료 효과 및 안전성 프로파일 확인
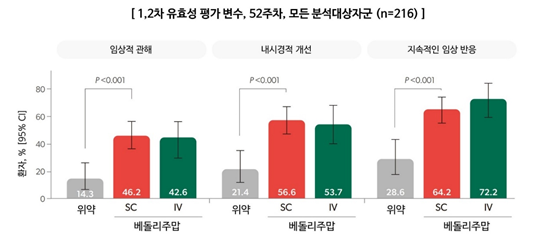
킨텔레스 피하주사는 VISIBLE 1 임상연구를 통해 성인 궤양성대장염 환자의 유지 치료에 대한 우수한 치료 효과 및 안전성 프로파일을 확인했다.
VISIBLE 1은 3상, 무작위 배정, 플라시보 대조, 이중맹검, 이중위약 연구로, 29개국 141개 기관의 중등도-중증 성인 궤양성대장염 환자를 대상으로 시행되었다. 216명을 분석한 연구 결과, 피하주사는 이전 항TNF 치료 경험과 관계없이 위약군 대비 정맥주사와 일치하는 유의한 효과, 안전성 프로파일(주사부위반응 제외), PK 노출, 면역원성을 보였다. 환자 평가 결과 또한 유효성, 안전성, 내약성 결과와 일치하게 개선되어 환자 삶의 질에 유익한 효과를 확인했다.
▲크론병에서 유의하게 결과 개선, 안전성 프로파일과 함께 효과적인 치료 유지 효과 확인
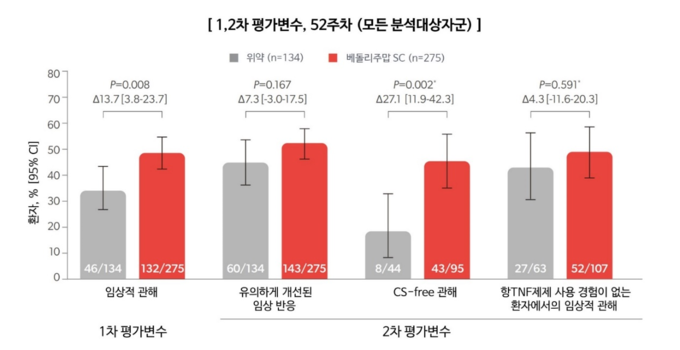
성인 크론병 환자의 유지 치료로 킨텔레스 피하주사를 평가한 VISIBLE 2 임상 연구에서도 우수한 치료 효과 및 안전성 프로파일을 확인했다.
VISIBLE 2는 3상, 무작위 배정, 플라시보 대조, 이중맹검 연구로, 30개국 169개 기관의 중등도-중증 성인 크론병 환자를 대상으로 시행되었다. 410명에 대한 연구 결과, 1차 평가변수인 52주차에서 임상적 관해를 킨텔레스 피하주사 유지 치료군의 48.0%가 달성했다. (위약군 34.3%) 피하주사 유지 치료군과 위약군 간 전체 안전성 결과는 유사했다.
+ 보편적 치료(코르티코스테로이드제나 면역억제제 등의 치료) 또는 종양괴사인자 알파(Tumor
Necrosis Factor-α) 억제제 치료에 반응을 나타내지 않거나, 반응이 없어지거나, 또는 내약성이 없는 중등도에서 중증의 활성 크론병의 치료
† 보편적 치료(코르티코스테로이드제나 면역억제제 등의 치료) 또는 종양괴사인자 알파(Tumor Necrosis Factor-α) 억제제 치료에 반응을 나타내지 않거나, 반응이 없어지거나, 또는 내약성이 없는 중등도에서 중증의 활성 궤양성 대장염의 치료
+ Nominal p-values that cannot be considered for statistical significance.
다케다제약(Takeda Pharmaceutical Company Limited)
다케다제약은 글로벌 가치 기반 연구개발 중심의 바이오제약 선두기업으로, 일본에 본사를 두고 있다. 다케다제약은 의약품 혁신을 통해 환자들의 보다 건강한 삶과 더 나은 미래(Better Health, Brighter Future)를 만들어 가기 위해 헌신하고 있다. 특히 항암제, 위장관질환, 신경계질환, 희귀질환 등 4대 핵심 치료 분야 연구에 집중하고 있다. 또한 혈장유래제제 및 백신의 연구개발에도 투자하고 있다. 다케다제약은 새로운 치료 옵션을 발전시키고 탄탄한 파이프라인을 구축할 수 있는 역량 및 연구개발 협력을 통해 전세계 많은 이들의 삶에 긍정적인 영향을 줄 수 있는 혁신적인 신약 개발에 정진하고 있다. 임직원은 전세계 약 80개국에서 다양한 헬스케어 파트너와 협력하며 환자들의 삶의 질 향상을 위해 헌신하고 있다. 더 자세한 정보는
https://www.takeda.com에서 찾을 수 있다.
한국다케다제약㈜
한국다케다제약은 싱가포르에 위치한 다케다제약 아시아태평양 지역본부 소속으로, 2011년 4월 국내에 설립돼 한국 내 마케팅 및 영업을 영위해 오고 있다. 한국다케다제약은 환자의 건강 증진을 최우선으로 하는 기업 이념과 ‘성실(Integrity)’의 핵심 가치를 기반으로 엄격한 윤리기준을 준수하며 의약품과 관련 정보를 제공하고 있다.
킨텔레스주프리필드시린지주/킨텔레스프리필드펜주 허가사항 전문은 식약처 의약품안전나라의 제품 허가사항을 참고하시기 바랍니다.
References
1 식품의약품안전처 품목기준코드 202200738
Accessed on Feb 8, 2022
2022
5 Entyvio product information. ttps://tga-search.clients.funnelback.com/s/search.html?collection=tga-artg&profile=record&meta_i=317262 accessed on Feb 14, 2022
7 Sandborn WJ, et al. Efficacy and safety of vedolizumab subcutaneous formulation in a randomized trial of patients with ulcerative colitis. Gastroenterology 2020;158:562-572.
8 Vermeire S, et al. Efficacy and safety of subcutaneous vedolizumab in patients with moderately to severely active Crohn’s disease: Results from the VISIBLE 2 randomised trial. J Crohns Colitis 2022 Jan 28;16(1):27-38.