노바티스, 척추관절염 치료에서 리더십 강화
• 건선에 이어 강직성 척추염, 건선성 관절염까지…모든 적응증에서 5년 장기 데이터 입증하며 코센틱스의 독보적 입지 강화1,2,3
• MEASURE1, FUTURE1 임상 3상 연구에서 강직성 척추염과 건선성 관절염의 징후와 증상의 빠른 개선 및 5년차 효과 유지 확인1,2
• 코센틱스, 생물학적 제제로 신규 또는 대체 치료하는 건선성 관절염 환자에게 미국서 가장 많이 처방되는 생물학적 제제4
노바티스 코센틱스®(성분명: 세쿠키누맙)가 강직성 척추염과1 건선성 관절염2 환자를 대상으로 실시한 3상 연구 결과, 투여 5년차에서도 증상 개선 효과 및 안전성이 유지된 것이 확인됐다. 이번 새로운 데이터는 지난 19일부터 24일까지 미국 시카고에서 개최된 2018 미국류마티스학회(ACR/ARHP) 연례학술대회에서 발표됐다.
이번에 발표된 강직성 척추염과 건선성 관절염 임상 장기 데이터는 복합적이고 다면적인 이 두 질환을 장기적으로 관리하는 코센틱스의 핵심적 역할을 뒷받침한다. 코센틱스의 MEASURE 1과 FUTURE 1의 새로운 장기 데이터는 각각 코센틱스가 강직성 척추염과 건선성 관절염 환자의 징후와 증상을 빠르게 개선하고 그 효과를 5년 내내 유지 시킨다는 것을 확인했다1,2. 두 장기 연구에 참여했던 환자들 가운데 5년 전체 치료 과정을 마친 환자는 80% 이상이었으며 1,2, 안전성 프로파일은 기존 보고 내용과 일치했다3,5,6.
특히, FUTURE 1 에서는 건선성 관절염 환자의 83%와 94%가 각각 골부착부염과 손발가락염에서 완전 관해에 도달했다.2
이로써 코센틱스는 건선 치료를 받은 환자 중 2/3가 5년간 피부 질환으로 인한 삶의 질 저하에 영향이 없음을 확인한 SCULPTURE 연구에 이어, 척추관절염에서도 5년 장기 데이터를 확보하게 됐다3.
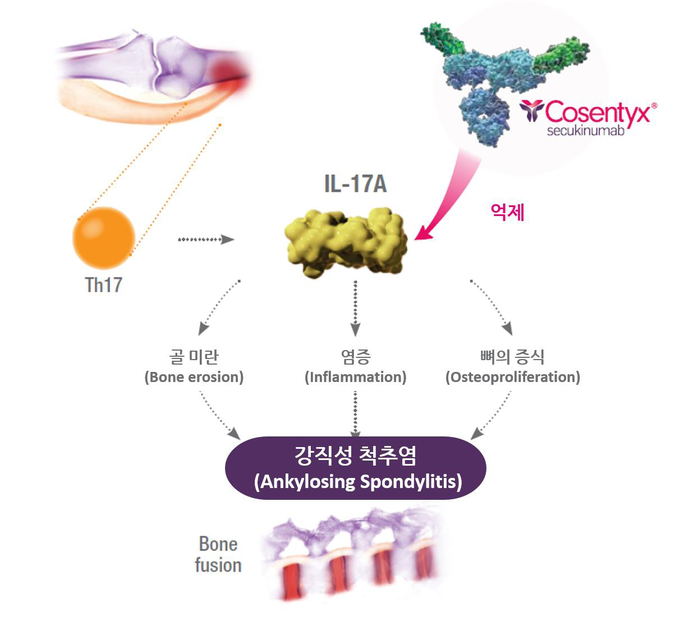
강직성 척추염과 건선성 관절염은 모두 만성적인 진행성, 소모성 질환으로 환자의 일상과 삶의 질에 상당한 영향을 줄 수 있다7-9. 때문에 치료제를 선택할 때, 장기적인 효능과 긍정적인 안정성 프로파일 고려하는 환자와 의사들이 점차 늘고 있다1,3,10. 코센틱스는 강직성 척추염과 건선성 관절염 진행에 관여하는 핵심 사이토카인인 인터루킨-17A(IL-17A)를 선택적으로 억제해 장기적이고 포괄적인 치료를 가능하게 한다11-14.
한국 노바티스의 조쉬 베누고팔 대표는 “5년 데이터는 치료제의 장기적인 효능과 안전성을 입증하는 기준으로 볼 수 있다. 코센틱스는 기존의 건선 5년 데이터에 강직성 척추염과 건선성 관절염을 대상으로 한 5년 데이터를 추가함으로써, 견고한 치료 프로파일을 강화하는 동시에, 척추관절염과 건선에 대한 완전한 치료를 찾는 환자들에게 새로운 표준 치료를 제시하고 있다”고 말했다.
한편, 코센틱스는 국내에서 강직성 척추염, 건선성 관절염, 판상 건선 치료에 모두 사용 가능한 유일한 IL-17A 억제제이며15,16, 건강보험 급여가 적용 된다.17 이 세 가지 질환은 모두 세부 요건 충족 여부에 따라 산정특례가 적용돼18 해당 환자는 절차에 따라 본인부담률이 10%로 경감된다.19
MEASURE 1
MEASURE 1은 2년간 진행된 다기관, 무작위, 위약 대조 3상 연구로, 활동성 강직성 척추염 환자를 대상으로 코센틱스의 효능과 안전성을 평가했다20. 1차 유효성 평가 항목은 치료 16주째 증상의 20% 이상 개선을 의미하는 ASAS 20 반응(국제척추관절염 평가학회 반응기준)에 도달한 환자 비율에서 위약 대비 코센틱스의 우월성이었다21. 치료 16주째부터 위약군 환자들은 ASAS 20 반응에 따라 다시 무작위로 코센틱스 75mg 또는 150mg을 투여했다. 이러한 교차투여는 ASAS 20반응이 없는 경우 16주째부터, 반응이 있는 경우 24주째부터 실시했다10.
371명의 환자 중 총 290명이 임상을 마쳤으며, 이후 274명은 3년간의 연장 연구에 참여했다1,6,20. 연장 연구에 참여한 환자 중 80% 이상이 5년간의 코센틱스 치료를 마쳤다1. 코센틱스 75mg 치료를 받은 환자의 56%는 168주 이후 코센틱스 150 mg으로 증량했다1. ASAS 20 반응과 ASAS 40 반응에 따른 증상 개선은 모든 투여 용량군에서 5년 내내 유지됐다 1. 용량 증량군에서 ASAS 20 반응은 코센틱스 75mg의 경우 74% 개선에서 72주째 이후 코센틱스 150 mg에서 82%로 개선됐다1. 코센틱스의 안전성 프로파일은 다수의 적응증에 대한 기존 임상시험에서 관찰된 것과 일치했다 3,5,6.
FUTURE 1에 대해
FUTURE 1은 2년간 진행된 다기관, 무작위, 위약 대조 3상 연구로 활동성 건선성 관절염 환자를 대상으로 코센틱스의 효능을 평가했다10. 본 연구에는 활동성 건선성 관절염 환자 606명이 등록되었으며, 환자들은 코센틱스를 정맥 투여(10mg/kg) 받은 뒤 이후 유지 요법으로 코센틱스를 피하 투여(75mg, 150mg) 받았다10. 1차 유효성 평가 항목은 치료 24주째 ACR 20 반응에 도달한 환자 비율에서 위약 대비 코센틱스의 우월성이었다10. 치료 16주째부터 위약군 환자들을 다시 무작위로 나눠 임상 반응에 따라 치료 16주째 또는 24주째에 코센틱스 75mg 또는 150mg을 투여했다10.
처음 2년 연구 이후 총 460명의 환자가 3년간의 연장 연구에 참여했다2. 환자의 80% 이상이 5년간의 코센틱스 치료를 모두 받았다2. 코센틱스 치료를 받은 환자들은 5년 내내 건선성 관절염의 징후와 증상의 개선이 유지됐으며, 이들 가운데 골부착부염과 손발가락염은 각각 83%와 94%의 환자가 완전 관해에 도달했다2. 코센틱스는 연구 기간 동안 150mg 또는 300mg의 증량에 비례해 효능의 개선을 보였다2. 코센틱스의 안전성 프로파일은 다수의 적응증에 대한 기존 임상시험에서 관찰된 것과 일치했다3,5,6.
SCULPTURE 5년 연장 연구에 대해22,23
SCULPTURE 핵심 3상 연구에서 5년 연장된 다기관, 이중맹검, 오픈라벨 연구다. 연장 연구의 1차 목적은 중등도에서 중증의 판상 건선 환자를 대상으로 코센틱스의 장기 안전성과 내약성을 평가해 치료와 삶의 질 성과를 알아보는 것이다.
유효성 척도에는 건선 환자들의 피부 개선도를 측정하는 점수인PASI가 75% 이상, 90% 이상, 100% 개선됐음을 의미하는 PASI 75, PASI 90, PASI 100에 도달하는 환자 비율과 DLQI로 측정한 삶의 질 개선이 포함됐다. 장기간에 걸쳐 진행된 연장 연구에서 코센틱스의 효과와 안전성이 지속되는 것이 입증됐다. 관찰 분석 내용에는 치료 1년 차 PASI 75/90/100 (각각 88.9%, 68.5% and 43.8%), 5년 차 PASI 75/90/100 (88.5%, 66.4% and 41%); 치료 1년 차 절대 PASI ≤1/≤2/≤3 반응률 (각각 58.6%, 67.9%, 74.1%), 5년 차 절대 PASI ≤1/≤2/≤3 반응률 (각각 53.3%, 66.4%, 75.4%), 1년 차 DLQI 0/1 (72.7%), 5년 차 DLQI 0/1 (65.5%), 장기 안전성과 내약성이 포함됐다.
핵심 3상 SCULPTURE 연구에서는 치료 12주 차 PASI 75 반응을 보인 환자들이 이중맹검 방식으로 무작위 배정돼 코센틱스 300 mg 또는 150 mg의 유지 요법을 받았으며, 약물은 4주마다 고정적 또는 필요에 따라 재치료하는 방식으로 진행됐다. 52주간의 SCULPTURE 연구를 완료한 환자들은 연장 연구에서 동일한 용량과 요법으로 치료를 계속 받을 수 있게 했다 (N=642). 연장 연구에 참가한 환자들은 이전과 동일한 이중맹검 치료를 3년 간 지속했으며, 이후 5년 차 완료 시점까지는 오픈라벨 방식으로 진행됐다. (260주째 n=126). SCULPTURE 연구에서는 국부 치료가 허용되지 않았으나 연장 연구에서는 두피, 얼굴, 또는 생식기 주위에 한해 최대 14일간 국부 치료가 허용됐다. 코센틱스의 안전성 프로파일은 기존에 알려진 것과 일치했다.
코센틱스® (세쿠키누맙) 에 대해
코센틱스는 강직성 척추염, 건선성 관절염, 건선에서 염증과 질환의 진행에 관여하는 핵심 사이토카인 IL-17A를 선택적으로 억제하는 최초이자 유일한 완전 인간 단클론 항체(fully human monoclonal antibody) 치료제다10-13.
IL-17A는 기계적인 스트레스로 인해 촉발 될 수 있는 내재면역계 및 적응면역계의 다양한 세포에 의해 생성된다24. 코센틱스는 발매 이후 지금까지 전 세계 16만명 이상의 건선, 강직성 척추염, 건선성 관절염 환자들에게 사용되어 왔으며25, 직접 비교 임상 프로그램을 포함해 100여건의 연구를 통해 평가되고 있다26-32.
노바티스(Novartis)에 대하여
노바티스는 인류의 생명 연장과 삶의 질 개선을 목표로 의약품 혁신에 매진하는 세계적인 제약 기업이다. 업계를 선도하는 노바티스는 최첨단 과학기술과 디지털 기술을 접목하여 사회와 환자가 필요로 하는 혁신적인 의약품 개발에 앞장서고 있으며, 매년 세계에서 R&D에 가장 많은 투자를 하는 기업 순위에 이름을 올리고 있다.
노바티스의 의약품으로 치료받는 인구는 전 세계적으로 약 10억여명에 달하며 최신 의약품에 대한 환자 접근성을 높이는 혁신적인 방안들을 도입하고자 하는 노바티스의 노력은 현재도 계속되고 있다. 전 세계 각지에서 140여개 국가 출신 125,000명의 노바티스 임직원들이 근무하고 있다. 보다 자세한 내용은 www.novartis.com에서 확인할 수 있다.
한국노바티스(Novartis Korea)에 대하여
세계적인 제약•바이오 기업, 노바티스의 자회사인 한국노바티스(www.novartis.co.kr) 는 제네릭사업부인 한국산도스와 안과사업부인 한국알콘을 포함해 약 740 여 명의 직원을 두고 있다. 한국노바티스는 지난 10년 간 한국에서만 약 200 여 건의 임상시험을 진행하여 국내 연구진과의 협력을 활발히 진행하고 있으며, 환우 및 가족 정서 지원 프로그램인 ‘치유(CHEER YOU)’, 환우의 사회 복귀 지원 프로그램 ‘이음’, 여성 암환자 지원 프로그램인 ‘가화맘사성’과 매년 전 직원이 자원봉사활동에 참여하는 ‘지역 봉사의 날’ 행사 등 다채로운 사회공헌활동을 통해 지역 사회에 이바지 하는 기업이 되기 위해 최선을 다하고 있다.
References
1. Baraliakos X et al. Long-term Evaluation of Secukinumab in Ankylosing Spondylitis: 5 Year Efficacy and Safety Results from a Phase 3 Trial. Presented as a late-breaking abstract at the American College of Rheumatology Annual Meeting, 2018.
2. Mease PJ et al. Secukinumab Provides Sustained Improvements in the Signs and Symptoms in Psoriatic Arthritis: Final 5 Year Efficacy and Safety Results from a Phase 3 Trial. Abstract presented at the American College of Rheumatology Annual Meeting, 2018.
3. Bissonnette R. et al. Secukinumab Demonstrates High Sustained Efficacy and a Favorable Safety Profile in Patients with Moderate to Severe Psoriasis through 5 Years of Treatment (SCULPTURE Extension Study). J Eur Acad Dermatol Venereol. 2018; 32(9):1507-1514.
4. Novartis, data on file. IQVIA NBRx Data August 2018 and SHS PTD (Patient Transactional data) from August 2018. August 2018.
5. Mease PJ et al. Secukinumab Provides Sustained Improvements in the Signs and Symptoms of Active Psoriatic Arthritis through 3 Years: Efficacy and Safety Results from a Phase 3 Trial. Presented at the American College of Rheumatology 2016. Presentation number 961.
6. Braun J et al. Secukinumab demonstrates low radiographic progression and sustained efficacy through 4 years in patients with active ankylosing spondylitis. Late breaking abstract presented at the 2017 ACR/ARHP Annual Meeting, San Diego, USA. 7th November 2017.
7. Mease PJ et al. Managing patients with psoriatic disease: the diagnosis and pharmacologic treatment of psoriatic arthritis in patients with psoriasis. Drugs 2014;74:423-41.
9. Sieper J et al. Ankylosing spondylitis: an overview. Ann Rheum Dis 2002; 61 (Suppl III):iii8‒iii18.
10. Mease PJ et al. Secukinumab inhibition of interleukin-17A in patients with psoriatic arthritis. N Engl J Med. 2015; 373(14):1329-39.
12. Smith JA et al. Review: The Interleukin 23/Interleukin 17 Axis in Spondyloarthritis Pathogenesis: Th17 and Beyond. Arthritis Rheumatol. 2014;66:231–41.
13. Nestle FO et al. Mechanisms of disease psoriasis. N Eng J Med. 2009;361:496–509.
14. Girolomoni G et al. Psoriasis: rationale for targeting interleukin-17. Br J Dermatol. 2012;167:717–24.
15. 코센틱스센소레디펜_NSS_v1.0_2017.08.02
17. 보건복지부 고시 제2017 - 136호
19. 희귀난치성질환 산정특례 검사기준 및 필수 검사항목
20. Braun J et al. Effect of secukinumab on clinical and radiographic outcomes in ankylosing spondylitis: 2-year results from the randomised phase III MEASURE 1 study. Ann Rheum Dis. 2016;doi: 10.1136/annrheumdis-2016-209730.
21. Baeten D et al. Secukinumab, interleukin-17A inhibition in ankylosing spondylitis. N Engl J Med. 2015; 373:2534–48.
22. Bissonnette R et al. Secukinumab demonstrates high sustained efficacy and a favorable safety profile through 5 years of treatment in moderate to severe psoriasis. Eposter presented at 2018 American Academy of Dermatology (AAD) Annual Meeting; February 16–20, 2018, San Diego, California. Poster #7382.
23. Bissonnette R et al. Secukinumab demonstrates high sustained efficacy and a favorable safety profile through 5 years of treatment in moderate to severe psoriasis. Presented as eposter P2223 at 26th EADV Congress 2017. 13th September 2017.
24. Schett G et al. Enthesitis: from pathophysiology to treatment. Nat Rev Rheumatol. 2017: 21;3(12):731-741.
25. Novartis, data on file.
28. Langley RG et al. Secukinumab in Plaque Psoriasis — Results of Two Phase 3 Trials. N Engl J Med 2014;371:32w6-38.
29. Blauvelt A et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate-to-severe plaque psoriasis up to 1 year: Results from the CLEAR study. J Am Acad Dermatol. 2017 Jan;76(1):60-69.
30. Bagel J et al. Secukinumab is Superior to Ustekinumab in Clearing Skin of Patients with Moderate to Severe Plaque Psoriasis: CLARITY, a Randomized, Controlled, Phase 3b Trial. Presented as poster 98 at The Winter Clinical Dermatology Conference – Hawaii. January 13, 2018.