MEASURE 3연구 결과,
약 30%가 ASAS 부분적 관해 달성 및 TNF 억제제 경험 유무에 관계없이 지속적인 효과 확인
한국노바티스㈜(대표 조쉬 베누고팔)의 인터루킨-17A(IL-17A) 억제제인 코센틱스®(성분명: 세쿠키누맙)가 8월 4일 활동성 강직성 척추염 환자에서 임상 반응에 따라 1회 300mg 용량으로 증량해 치료할 수 있게 허가사항이 확대됐다.
이번 허가 확대로 코센틱스는 기존 치료에 대한 반응이 적절하지 않은 활동성 강직성 척추염 치료를 위해 1회 150 mg으로 제 0, 1, 2, 3, 4주 피하투여 및 그 이후에는 매 달 (4주마다) 피하투여하는 기존 치료에 더해 임상 반응에 따라 용량을 1회 300 mg로 증량할 수 있는 옵션이 추가됐다. 1
이번 허가 확대는 활동성 강직성 척추염 환자를 대상으로 코센틱스 150mg과 300mg 용량의 3년간 효과와 안전성 프로파일을 확인한 MEASURE 3 연구가 근거가 됐다.
MEASURE3 연구결과, 코센틱스 300mg은 주요 효능 평가 변수, 특히 부분적 관해 등 달성하기 힘든 평가 변수에 대해 특히 TNF 억제제에 불충분한 반응을 보이는 환자에서 수치적으로 더 높은 반응을 확인했다. 코센틱스 300mg 환자군의 약 30%가 치료 3년 동안 관해에 가까워졌으며†, 80% 이상의 환자가 치료를 유지했다. 또한, TNF 억제제 치료 경험 유무와 관계없이 모두 지속적인 효과를 확인했다. 안전성 면에서 기존 150mg 용량과 임상적으로 의미있는 차이는 없었다. 2
한국노바티스 코센틱스 사업부 조셉 리우(Joseph Liu) 전무는 “강직성 척추염 치료에서 코센틱스 150mg에 이어 300mg을 통해 더욱 높은 치료 반응률과 관해를 이끌어 낸 것은 매우 고무적인 일”이라며, “코센틱스는 빠르고 지속적인 효과와 척추 구조 변형 억제 효과를 보유한 치료제로, 이번 300mg 용량을 통해 더욱 효과적인 질환 관리를 가능하게 하는 치료 옵션을 제공하게 될 것”이라고 말했다.
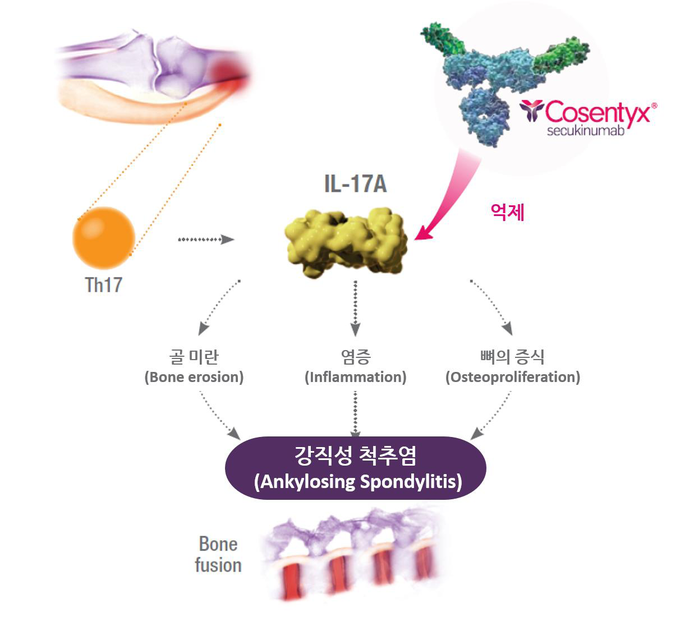
한편, 코센틱스는 IL-17A 단백질을 선택적으로 억제하는 최초의 강직성 척추염 및 건선성 관절염 치료제다. 국내에서는 2015년 9월 광선요법 및 전신요법(약품이 전신에 흡수되어 전신으로 퍼지는 치료법)을 필요로 하는 중등도 및 중증의 성인 판상 건선 치료제로 식품의약품안전처의 승인을 받았으며, 2016년 2월 강직성 척추염과 건선성 관절염에 대해 추가로 적응증을 승인 받은 바 있다. 국내에서 2017년 8월부터 건선에서는 1차, 강직성 척추염과 건선성 관절염에서는 2차 생물학적 제제로 급여가 인정되고 있다.
참고 자료
MEASURE 32
MEASURE 3은 156주간 진행된 다기관, 무작위, 이중맹검, 위약 대조, 병행 설계 3상 연구로, 활동성 강직성 척추염 환자를 대상으로 코센틱스의 150mg과 300mg 용량의 효능과 안전성을 평가했다. 본 연구에는 활동성 강직성 척추염 환자 226 명이 등록되었으며, 무작위로 코센틱스 10 mg을 (기저선, 2 주 및 4 주) 정맥 투여 후 8주차부터 4주마다 코센틱스 300mg 이나 150 mg을 피하투여했다. 위약군은 동일한 정맥 투여 일정에 따라 치료 받았으며, 16주 차에 코센틱스 300mg이나 150mg을 4주마다 피하투여 받도록 재배정됐다. 환자 중 약 75%는 TNF 억제제 치료 경험이 없는 환자였다.
1차 평가 변수는 16주 차에 증상의 20% 이상 개선을 의미하는 ASAS 20을 충족한 환자 비율이었다. 156주까지의 결과에는 ASAS 20, ASAS 40 반응, 기저선으로부터 총 BASDAI 점수 변화, ASAS PR, ASDAS-CRP에서 비활성 질환, BASDAI 50 반응, ASAS 5/6 반응이 포함됐다.
연구 결과, 16주부터 156주까지의 치료 유지율은 코센틱스 300mg투여 군과 150mg 투여 군에서 각각 80.5%, 80.9%로 나타났다. 156주 ASAS 20/40 반응률은 각각 코센틱스 300mg 투여군에서 75%/56.5%, 코센틱스 150mg 투여 군에서 68.2%/47.7% 였다. 156주차에 특히, TNF 억제제에 불충분한 반응을 보이는 환자 군에서 보다 엄격한 임상 평가 변수(ASAS 40, ASAS-PR)에 대한 반응률이 코센틱스 300mg 투여 군에서 높았다. 코센틱스 300mg은 안전성 면에서 150mg와 임상적으로 의미있는 차이가 없었다.
† ASAS partial remission을 바탕함. 전체 모집단에서 ASAS 부분 관해 (ASAS PR) 반응은 코센틱스 150mg과 코센틱스 300mg 에서 52주차에 각각 15.8%, 25.8%이였고, 104 주차에는 18.5%, 29% 이였다. 이러한 반응은 156 주차 (코센틱스 150mg는 15.9 %, 코센틱스 300mg는 28.3 %)까지 유지되었다. 특히 156주차에 TNF 억제제에 불충분한 반응을 보이는 환자에서 코센틱스 300mg의 ASAS PR 반응은 29.4%였다.
노바티스(Novartis)에 대하여
노바티스는 인류의 생명 연장과 삶의 질 개선을 목표로 의약품 혁신에 매진하는 세계적인 제약 기업이다. 업계를 선도하는 노바티스는 최첨단 과학기술과 디지털 기술을 접목하여 사회와 환자가 필요로 하는 혁신적인 의약품 개발에 앞장서고 있으며, 매년 세계에서 R&D에 가장 많은 투자를 하는 기업 순위에 이름을 올리고 있다. 노바티스의 의약품으로 치료받는 인구는 전 세계적으로 약 10억여명에 달하며 최신 의약품에 대한 환자 접근성을 높이는 혁신적인 방안들을 도입하고자 하는 노바티스의 노력은 현재도 계속되고 있다. 전 세계 각지에서 140여개 국가 출신 125,000명의 노바티스 임직원들이 근무하고 있다. 보다 자세한 내용은 www.novartis.com에서 확인할 수 있다.
한국노바티스(Novartis Korea)에 대하여
세계적인 제약•바이오기업, 노바티스의 자회사인 한국노바티스(www.novartis.co.kr)는 계열사인 한국산도스를 포함해 약 580여 명의 직원을 두고 있다. 한국노바티스는 지난 10년 간 한국에서만 약 200 여 건의 임상시험을 진행하여 국내 연구진과의 협력을 활발히 진행하고 있으며, 환우 및 가족 정서 지원 프로그램인 ‘치유(CHEER YOU)’, 환우의 사회 복귀 지원 프로그램 ‘이음’, 여성 암환자 지원 프로그램인 ‘가화맘사성’과 매년 전 직원이 자원봉사활동에 참여하는 ‘지역 봉사의 날’ 행사 등 다채로운 사회공헌활동을 통해 지역 사회에 이바지하는 기업이 되기 위해 최선을 다하고 있다.
References
1 식품의약품안전처 의약품 수입품목 허가사항 변경허가. 4 Aug 2020
2 Pavelka K, et al. Secukinumab 150/300 mg Provides Sustained Improvements in the Signs and Symptoms of Active Ankylosing Spondylitis: 3-Year Results from the Phase 3 MEASURE 3 Study. ACR Open Rheumatology. 2020;2:119-27
3 Cosentyx EMA assessment report 22 Oct 2015 (EMA/CHMP/665405/2015)
4 코센틱스 제품설명서. 2016
8 보건복지부 고시 제2017 – 136호