SUNFISH 임상연구의 3년 데이터 분석 결과, 에브리스디 투여 3년 차에서도 운동 기능 개선 효과 유지 및 우수한 내약성 확인, 이상반응 비율은 감소2
SUNFISH Part2 임상연구의 대조군과 비교한 탐색적 분석 결과, 에브리스디 2년 투여군에서 운동 기능의 현저한 개선 또는 안정화 확인3
RAINBOWFISH 임상연구의 새로운 중간 분석 결과, 에브리스디로 12개월 이상 치료 받은 영아 환자 대부분이 건강한 영아와 동일한 발달 시기에 스스로 일어서거나 걸을 수 있는 것으로 확인4
현재까지 전 세계 척수성 근위축증 환자 5,000여명이 에브리스디로 치료 받아…국내에서는 2020년 11월 허가 후 급여 논의 단계
㈜한국로슈(대표이사 닉 호리지)는 자사의 척수성 근위축증(SMA, Spinal Muscular Atrophy) 치료제 에브리스디(성분명: 리스디플람)가 폭넓은 유형의 환자에서 장기 효능과 안전성 프로파일을 확인한 3건의 신규 임상 결과를 발표했다고 밝혔다2,3,4.
해당 데이터는 3월 13~16일 미국 테네시주에서 개최된 2022 근위축증협회 임상과학 컨퍼런스(MDA, Muscular Dystrophy Association Clinical & Scientific Conference)에서 공개됐다.
새롭게 공개된 연구 내용은 2~25세의 제 2형 또는 제 3형의 폭넓은 척수성 근위축증 환자군을 대상으로 에브리스디의 장기 효능과 안전성을 확인한 ▲SUNFISH 3년 데이터 분석2, 치료 받지 않은 외부 대조군 대비 에브리스디의 운동 기능 개선 및 안정화 효과를 확인한 ▲SUNFISH Part2 2년 탐색적 데이터 분석3, 척수성 근위축증 사전 징후가 있는 생후 2개월 미만의 영아를 대상으로 한 ▲RAINBOWFISH 임상연구의 새로운 중간 분석4 결과다.
▲SUNFISH 3년 데이터 분석 결과에 따르면, 에브리스디 치료 후 1년 차에 확인된 운동기능평가척도(MFM-32, motor function measure-32) 총점 개선이 치료 3년 차까지 유지된 것으로 나타났다2. 이와 마찬가지로 상지기능평가(RULM, revised upper limb module)와 해머스미스 기능성 운동 확대 지수(HFMSE, hammersmith functional motor Scale expanded)에서도 개선 효과가 1~3년 차 동안 유지됐다2.
해당 연구에서 에브리스디의 내약성은 3년 동안 우수한 것으로 나타났고, 일반적인 이상반응(AE, adverse events) 비율은 치료 3년 동안 감소하였고, 치료 3년 차에는 중증이상반응(SAE, serious adverse events) 비율의 감소 경향이 관찰됐다2. 대부분의 일반적인 이상반응(AE)과 중증이상반응(SAE)는 기저질환에 의한 것으로 치료와 관련된 이상반응(AE)으로 투약을 중단한 사례는 없었다2.
척수성 근위축증 치료를 받지 않은 외부 대조군과 에브리스디 투여군을 비교 평가하는 분석도 이뤄졌다3. ▲SUNFISH Part2 2년 탐색적 데이터 분석 결과에 따르면, 운동기능평가척도(MFM-32)에서 현저한 개선(3점 이상 증가) 또는 안정화(0점 이상 개선)를 보인 환자 비율이 치료 받지 않은 외부 대조군에 비해 24개월 동안 에브리스디를 투여 받은 환자군에서 더 높은 것으로 나타났다(각 p=0.025, p=0.002)3.
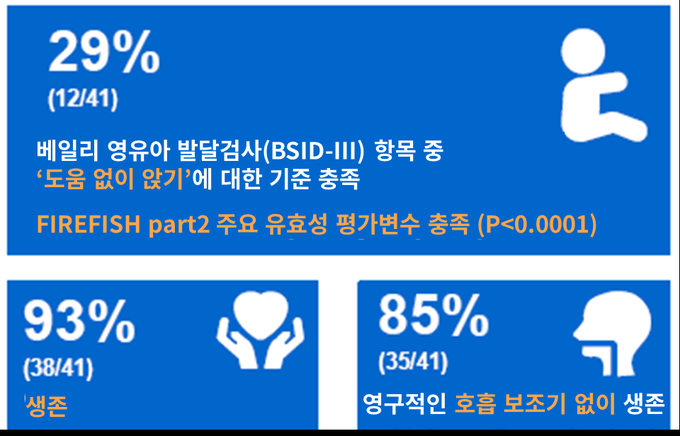
한편, 유전적으로 척수성 근위축증을 진단 받았지만 증상이 나타나지 않은 0~6주의(최초 투여 시점 기준) 영아를 대상으로 한 ▲RAINBOWFISH 임상연구의 중간 분석 결과, 에브리스디로 12개월 이상 치료 받은 환자 대부분이 건강한 유아와 동일한 발달 시기에 스스로 일어서거나 걸을 수 있는 것으로 확인됐다4. 이에 미국 식품의약국(FDA)은 지난 1월 척수성 근위축증(SMA) 사전 징후가 있는 생후 2개월 미만 영아 환자들의 치료를 위해 에브리스디에 대한 추가적 신약승인신청(sNDA, supplemental new drug application) 우선심사를 결정한 바 있다5.
한국로슈 의학부 이승훈 리드는 “이번 다양한 연구 데이터 발표는 생후 2개월 미만부터 2-25세까지 폭넓은 척수성 근위축증 환자군에서 에브리스디의 효능과 안전성을 추가로 확인한 것으로 특히, 3년 장기 치료에서도 효과와 안전성이 유지되고 치료가 진행될수록 이상반응이 감소했다는 사실은 고무적”이라고 밝히며 “한국로슈는 에브리스디의 치료 혜택이 국내 척수성 근위축증 환자들에게도 전해질 수 있도록 최선을 다할 것”이라고 말했다.
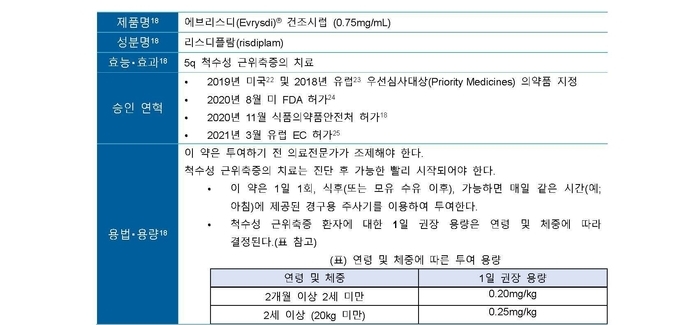
한편, 최초의 경구형 5q 척수성 근위축증 치료제인 에브리스디는 현재까지 전 세계 5,000여명 이상의 척수성 근위축증 환자의 치료에 사용됐다5. 조제된 액상형의 제제를 1일 1회 경구 복용하는 것으로 척수강 치료가 어려운 환자에도 적용 가능하며, 기존 척수강 내 주사 치료시 발생했던 입원, 등원 및 이에 수반되는 학업, 직장의 중단, 교통비용, 간병 등을 최소화해 사회경제적 부담을 절감하는 효과를 낸다. 영유아 환자에서는 연령 및 체중에 따른 환자 맞춤 처방7으로 약제비를 절감 효과를 기대할 수 있다.
국내에서는 2020년 11월 식약처의 허가를 받았고6 현재는 건강보험 급여 등재 신청 후 약 8개월째 급여 적용을 기다리고 있다. 다만, RAINBOWFISH 임상연구 결과 및 2개월 미만 영아 관련 데이터는 국내 허가사항에 포함되어 있지 않다
.
척수성 근위축증(Spinal muscular atrophy; SMA)에 대하여
척수성 근위축증은 운동 기능에 필수적인 생존운동신경세포(Survival Motor Neuron; SMN) 단백질 결핍으로 전신의 근육이 점차 약화되는 유전성 신경 근육 질환이다. 영아부터 성인기까지 발생하며 중추신경계뿐만 아니라 말초 조직에까지 영향을 미치는 질환으로 전신적인 치료가 필요하다. 증상 발현 시점과 최대 도달 가능한 운동 기능에 따라 크게 1형, 2형, 3형 등으로 구분되며10, 발생률은 1형이 가장 높으나 유병률은 2형, 3형이 높은 것으로 알려져있다. 유형에 따라 환자의 체력이나 걷고, 먹고, 호흡하는 능력이 현저히 감소하거나 상실될 수 있다5.
척수성 근위축증 환자는 SMN 단백질을 생성하는 SMN1 유전자에 돌연변이가 발생한 상태다10,11. 이 경우 이와 유사한 SMN2 유전자를 통해 SMN 단백질이 생성되나, 생성된 단백질의 10-20% 정도만 완전한 기능을 나타낸다10,11. 따라서, SMN2 유전자의 변이 정도와 SMA 증상 발현 정도가 연관된 것으로 알려져 있다10.
에브리스디건조시럽 0.75mg/ml (성분명: 리스디플람)에 대하여
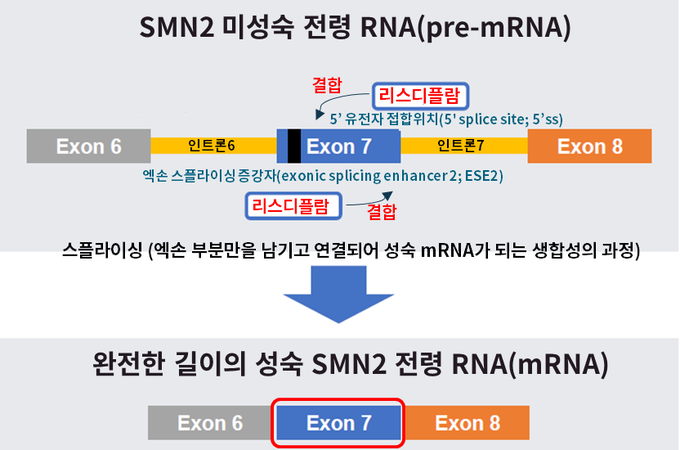
에브리스디는 5q 염색체 돌연변이에 의한 SMN 단백질 결핍으로 인해 발생하는 척수성 근위축증(SMA)의 치료를 위해 개발된 SMN2 미성숙 전령 RNA(pre-mRNA) 스플라이싱 조절제(splicing modifier)8로, SMN2 유전자의 미성숙 전령 RNA(pre-mRNA)에 결합해 온전한 기능의 SMN 단백질의 농도를 증가, 유지하는 기전의 치료제다11.
에브리스디는 액상형 제제를 1일 1회, 식후(또는 모유 수유 이후), 가능하면 매일 같은 시간(예; 아침)에 제공된 경구용 주사기를 이용하여 투여하게 되며, 중추신경계를 포함한 신체의 모든 부분에 골고루 분포하여 중추신경계와 전신에 SMN 단백질을 증가시킨다11.
에브리스디는 임상시험을 통해 영유아부터 성인까지 폭 넓은 연령대의 SMA 환자를 대상으로 치료 전후 운동기능 개선 효과와 안전성 프로파일을 확인했다8.
에브리스디는 2017년에 미국 식품의약국(FDA)에 의해 희귀의약품으로 지정되었으며 2018년에는 유럽의약품청(EMA)으로부터 의약품 신속평가 제도(PRIME) 대상으로 지정되었다5. 또한 에브리스디는 2021년 영국약리학회(BPS)로부터 올해의 신약발견상, 약물연구학회의 신약발견상을 수상했다5. 에브리스디는 현재 76개국에서 승인 받았으며, 29개국에서 승인 검토가 진행 중이다5.
에브리스디 임상시험에 대하여
SUNFISH2,3: 이 연구는 2개의 파트로 구성된 무작위(randomized), 이중맹검(double blind), 위약대조군(placebo controlled) 임상시험으로, 2세에서 25세까지의 2형 및 3형 척수성 근위축증 환자를 대상으로 진행됐다. 해당 임상은 척추측만증 환자 및 이전에 척추 측만증 수술을 받은 환자 등 다양한 임상적 조건의 환자군에서 위약군 대비 에브리스디의 유효성과 안전성을 확인했다. SUNFISH Part1은 적정 용량을 확인하기 위한 임상시험으로 구성되었으며, SUNFISH Part2는 Part1의 결과를 근거로 하여, 180명의 환자를 대상으로 선택된 용량용법에서 에브리스디의 유효성을 평가했다. 환자들은 에브리스디와 위약군에 2:1로 무작위배정되었다. Part1에 참여한 환자는 Part2에 참여하지 않았다. SUNFISH Part1 및 Part2에서 주요 유효성 평가변수는 치료 12개월째에 기저치 대비 운동기능평가척도(MFM-32) 점수의 변화를 통해 측정됐다.
RAINBOWFISH4 : 유전적으로 척수성 근위축증(SMA)을 진단 받았지만 증상이 나타나지 않은 0~6주의 (최초 투여 시) 영아 약 25명를 대상으로 에브리스디의 효능, 안전성, 약동학 및 약력학을 평가하기 위해 설계된 오픈라벨, 단일군, 다기관 임상연구다. 현재 환자 등록이 완료됐다.
㈜한국로슈
㈜한국로슈는 세계 1위의 바이오 제약사인 로슈그룹의 한국법인으로 지난 1983년 설립되었다. 국내에는 로슈그룹의 제약사업 부문인 ㈜한국로슈와 진단사업 부문인 ㈜한국로슈진단이 있다. 혁신(innovation)을 지향하는 로슈그룹의 전략에 따라 ㈜한국로슈는 항암제, 면역억제제, 항바이러스제 등 다양한 분야에서 혁신 의약품을 제공하고 있으며, 다국적 임상시험을 국내에 적극 유치하고 다양한 의학 포럼을 개최하는 등 한국 의료 환경 발전에 기여하고 있다. 또한, ㈜한국로슈는 지역사회를 위해 책임을 다하는 기업시민으로서 환자들의 삶의 질 향상과 건강한 대한민국을 만들기 위해 노력하고 있다. ㈜한국로슈는 2007년부터 로슈그룹의 글로벌 사회공헌활동인 ‘어린이를 위한 걷기 대회(Children’s Walk)’를 개최, 한국의 소외된 아동을 돕고 있다. 2012년부터 암 환자들의 예술 활동 지원 사회공헌프로그램인 ‘힐링갤러리(Healing Gallery)’를 진행해 왔으며, 2018년에는 NGO 굿피플과 함께 기존의 ‘힐링갤러리’에 환자맞춤형 지원이 더욱 강화된 사회공헌활동인 ‘힐링투게더(Healing Together)’를 선보였다.
회사에 관한 자세한 정보는 홈페이지 www.roche.co.kr 에서 확인할 수 있다.
References
1 FDA NEWS RELEASE, FDA Approves Oral Treatment for Spinal Muscular Atrophy, August 07, 2020
2 John W Day, et al. SUNFISH Parts 1and 2: 3-year efficacy and safety of risdiplan in thpes 2 and 3 SMA, Muscular Dystrophy Association (MDA) Clinical and Scientific Conference, 13-16 March 2022
3 L Servais, et al. SUNFISH Part 2: 24-month efficacy of risdiplam compared with external control comparators, Muscular Dystrophy Association (MDA) Clinical and Scientific Conference, 13-16 March 2022
4 RS Finkel, et al. RAINBOWFISH: Preliminary efficacy and safety data in risdiplam-treated infants with presymptomatic SMA, Muscular Dystrophy Association (MDA) Clinical and Scientific Conference, 13-16 March 2022
5 Data on file (Roche MR, New data for Roche’s Evrysdi (risdiplam) demonstrate long-term efficacy and safety in a broad population of people with spinal muscular atrophy (SMA), 16 March, 2022
6 식품의약품안전처 의약품통합정보시스템> 의약품허가∙승인> 품목허가현황> 에브리스디건조시럽0.75mg/mL(리스디플람). Available at:
https://nedrug.mfds.go.kr/pbp/CCBAE01/getItemPermitIntro?sItemName=%EC%97%90%EB%B8%8C%EB%A6%AC%EC%8A%A4%EB%94%94%EA%B1%B4%EC%A1%B0%EC%8B%9C%EB%9F%BD0.75mg%2FmL(%EB%A6%AC%EC%8A%A4%EB%94%94%ED%94%8C%EB%9E%8C)&sEntpName=(%EC%A3%BC)%ED%95%9C%EA%B5%AD%EB%A1%9C%EC%8A%88 (as of Mar. 24. 2020)
8 Evrysdi Korean PI (Evrysdi-2020-11-02-1.0)
9 E.Chen, et al. Cost of treatment and supportive care for patients with spinal muscular atrophy (SMA): A real-world database analysis. Cure SMA Researcher Meeting. June 28–July 1, 2019
10 Matthew E. R. Butchbach. Copy Number Variations in the Survival Motor Neuron Genes: Implications for Spinal Muscular Atrophy and Other Neurodegenerative Diseases. Front Mol Biosci. 2016; 3: 7
11 Agnès Poirier, et al. Risdiplam distributes and increases SMN protein in both the central nervous system and peripheral organs. Pharmacol Res Perspect. 2018 Nov 29;6(6):e00447
12 Cathy Lally, et al. Indirect estimation of the prevalence of spinal muscular atrophy Type I, II, and III in the United States. Orphanet Journal of Rare Diseases (2017) 12:175