이전에 치료 경험이 있는 국소 진행성 또는 전이성 비소세포폐암(NSCLC) 환자를 위한 잠재적 치료 옵션으로 티쎈트릭® 승인 권고
백금 기반 화학 요법 치료 후 진행된 전이성 요로상피암(mUC) 환자 위한 잠재적 치료 옵션으로 티쎈트릭® 승인 권고
로슈는 최근 유럽의약품청(EMA: European Medicines Agency)의 약물사용자문위원회(CHMP: Committee for Medicinal Products for Human Use)에서 티쎈트릭®(성분명: 아테졸리주맙)이 이전에 화학요법으로 치료 받은 국소 진행성 또는 전이성 비소세포폐암 환자에게 단독 요법으로 ‘긍정적 의견(positive opinion)’을 획득했다고 발표했다. EGFR 또는 ALK 변이가 확인된 환자들은 이러한 변이에 대한 표적 치료제도 투여한 후에 티쎈트릭을 투여하였다. 티쎈트릭®은 대규모로 진행된 무작위 3상 임상시험인 OAK 연구와 무작위 2상 임상시험인 POPLAR 연구 결과를 기반으로 이 같은 긍정적인 의견을 받았다.
또한 CHMP는 이전에 백금 기반 화학요법으로 치료 받은 국소 진행성 또는 전이성 요로상피암 성인 환자를 위한 단독 요법으로 티쎈트릭®을 긍정적으로 권고했다. 해당 의견은 요로상피암 환자를 대상으로 진행된 무작위 3상 임상시험인 IMvigor211 연구와 단일군 2상 임상시험 IMvigor210 코호트(cohort) 1, 2 결과를 기반으로 했다.
로슈의 의학부 최고 책임자(Chief Medical Officer) 및 글로벌 제품 개발부 대표(Head of Global Product Develpment)인 산드라 호닝 박사는 “CHMP에서 티쎈트릭®을 긍정적으로 권고했다는 사실은 진행성 폐암 및 방광암 환자들에게 대단히 기쁜 소식이다. 의학적 발전에도 불구하고 해당 암 환자들의 장기 생존율은 다른 일반 암 환자들에 비해 낮기 때문이다”며, “CHMP가 장기 반응 등 티쎈트릭®의 주요 임상 데이터를 전반적으로 고려했다는 점은 고무적이다”고 말했다.
CHMP의 권고 의견에 따라 유럽연합 집행위원회가 곧 티쎈트릭® 허가 관련 결정 내용을 발표할 것으로 예상되고 있다. 티쎈트릭®은 전이성 비소세포폐암 환자와 백금 기반의 화학요법제 치료 중 또는 이후 질병이 진행된 국소 진행성 또는 전이성 요로상피암 환자의 치료 옵션으로 미국 외 여러 국가에서 이미 시판 승인을 받은 바 있다.
비소세포 폐암
폐암은 전세계적으로 암사망원인 1위다. 매년 159만명이 폐암으로 사망하고 있으며, 매일 전세계에서 폐암으로 인해 사망하는 사람은 4,350명에 달한다. 폐암은 크게 비소세포폐암(NSCLC)과 소세포폐암(SCLC) 두 가지 유형으로 나눌 수 있다. 이중 비소세포폐암이 가장 흔한 유형으로, 전체 폐암사례의 85%가 이에 해당한다.
전이성 요로상피암
전이성 요로상피암(mUC)은 치료예후가 좋지않고 치료옵션도 제한적인 질병으로, 미국을 제외한 대부분의 지역에서 30년 이상 치료에 진전을 보이지 못하고 있다. 요로상피암은 전세계에서 9번째로 흔한 암으로, 2012년 43만건의 환자가 발생했으며 매년 방광암으로 인한 사망자는 약 14만 5천명이다. 남성의 발병률이 여성보다 3배 높으며, 선진국의 발병률이 후진국 대비 3배 높다.
티쎈트릭®(성분명: 아테졸리주맙)
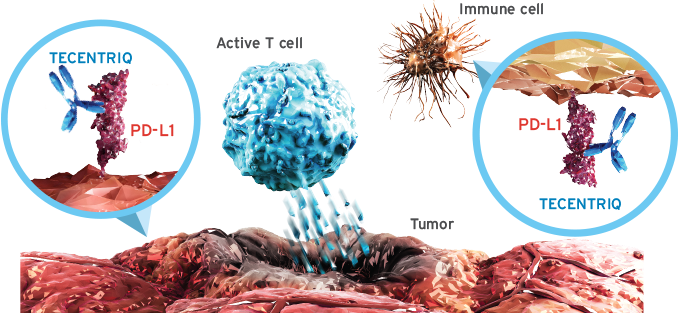
티쎈트릭®은 단클론항체로서PD-L1 단백질을 표적으로 하도록 설계되었다. 티쎈트릭®은 종양세포와 종양침윤 면역세포의 PD-L1과 결합해 PD-1, B7.1 수용체와의 상호작용을 차단하며, 이 를통해 T-세포를 활성화 할 수 있다.
티쎈트릭®은 광범위한 암종에서 면역항암제, 표적치료제, 다양한 항암화학요법과 기본 병용요법 약제로(foundational combination partner) 사용하여 개발 중이다.
티쎈트릭®의 안전성 결과는 전이성 요로상피암과 비소세포폐암 환자 2,160명을 종합한 데이터를 바탕으로 도출된 것이며, 가장 일반적인 부작용으로는 피로(35.4%), 식욕감퇴(25.5%), 메스꺼움 (22.9%), 호흡곤란 (21.8%), 설사 (18.6%), 발진 (18.6%), 발열(18.3%), 구토 (15.0%), 관절통 (14.2%), 무력감 (13.8%)과 소양증(11.3%)이 있다.