변경일자 : 2018년 3월 15일
한국 노보 노디스크제약(대표 라나 아즈파 자파)의 비만 치료제 삭센다®(성분명: 리라글루티드 3.0mg)’가 3월 15일 식품의약품안전처로부터 라벨 내 ‘치료효과 기간’ 및 ‘울혈성심부전 환자(NYHA Class I-II-III), 췌장염 병력 환자, 심장 및 뇌혈관 질환 환자의 주의’ 관련 문구의 삭제를 포함한 허가사항 변경 승인을 득했다.
내용 :
- 3월 15일, 한국 노보 노디스크제약(대표 라나 아즈파 자파)의 비만 치료제 삭센다®(성분명: 리라글루티드 3.0mg)’가 식품의약품안전처로부터 라벨 내 ‘치료효과 기간’ 및 ‘울혈성심부전 환자(NYHA Class I-II-III), 췌장염 병력 환자, 심장 및 뇌혈관 질환 환자의 주의’ 관련 문구의 삭제를 포함한 허가사항 변경 승인 득함
- ‘삭센다’ 허가사항 내 주요 변경 사항 정리
A. [용법용량] 내용 중
(문구 삭제) ‘이 약의 치료 효과는 1년의 기간에 대해서만 문서로서 뒷받침된다. 치료 지속의 필요성은 매년 재평가되어야 한다.’
(변경 근거) 3년간 진행된 삭센다 장기 임상 SCALE™(Satiety and Clinical Adiposity-Liraglutide Evidence) 연구 결과에 근거 (문서 하단 SCALE 임상소개 추가)
B. 【사용상의 주의사항】 3. (1) 내용 중
(변경 전) New York Heart Association (NYHA) class I-II의 울혈성심부전 환자에서는 이 약의 사용 경험은 제한적이므로, 이 약은 신중히 투여되어야 한다. NYHA class III-IV의 울혈성심부전 환자에서의 임상경험은 없으므로 이러한 환자에서 이 약의 투여는 권장되지 않는다.
(문구 삭제) New York Heart Association (NYHA) class I-II의 울혈성심부전 환자에서는 이 약의 사용 경험은 제한적이므로, 이 약은 신중히 투여되어야 한다. NYHA class III의 울혈성심부전 환자에서의 임상경험은 없으므로 이러한 환자에서 이 약의 투여는 권장되지 않는다.
(변경 후) New York Heart Association (NYHA) class IV의 울혈성심부전 환자에서의 임상경험은 없으므로 이러한 환자에서 이 약의 투여는 권장되지 않는다.
(변경 근거) LEADER™ (Liraglutide Effect and Action in Diabetes: Evaluation of cardiovascular outcome Results)
; 리라글루티드의 심혈관 질환 발생에 대한 임상시험으로서 일차 평가 기준은 FDA 지침에 따른 주요 심혈관 사건(CV 사망, 비 치명적 심근 경색 (심장 발작, 비치명적 뇌졸중)의 최초 발생에 이르기까지의 시간. LEADER™ 임상은 CV 위험이 높은 제 2 형 당뇨병 환자 9340명에게 리라글루티드 1.8mg의 5년 장기효과를 평가함.
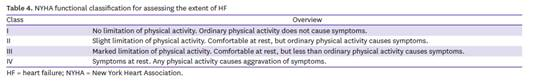
NYHA Class 소개
; NYHA는 New York Heart Association의 약어로 NYHA class는 NYHA에서 심부전(Heart Failure) 환자의 상태를 분류해 놓은 것입니다. Class에 따라 환자의 physical activity가 다르며, 호흡의 용이함 또한 차이가 있습니다.
Class I : 일상적인 신체 활동의 제약이 없는 환자.
Class II : 경미한 신체활동의 제약을 받는 환자. 휴식 시에는 안정적이나, 일상적인 활동으로도 피로나 호흡곤란 같은 증상들이 나타남.
Class III : 두드러진 신체 활동의 제약을 받는 환자. 휴식 시에는 안정적이나, 경미한 활동으로도 피로나 호흡곤란 같은 증상이 나타남.
Class IV : 일상적인 생활에 지장이 많을 만큼 신체활동에 제약이 있으며 쉴 때도 증상이 있는 환자
C. [사용상의 주의사항] 3. (4) 내용 중
(변경 전) 췌장염: GLP-1 수용체 효능제의 사용은 급성췌장염의 발생 위험성과 관련이 있다. 이 약에 대해서는 몇 건의 급성췌장염 보고사례가 있었다. 환자들에게 급성췌장염의 특징적인 증상들에 대해 알려주어야 한다. 만약 췌장염이 의심되면 이 약의 투여를 중단해야 하며, 급성췌장염이 확진되면 이 약 투여를 다시 시작하지 말아야 한다. 췌장염의 병력이 있는 환자들에서는 주의를 기울여야 한다.
(변경 후) 췌장염 : GLP-1 수용체 효능제의 사용으로 급성췌장염이 관찰되었다. 환자들에게 급성췌장염의 특징적인 증상들에 대해 알려주어야 한다. 만약 췌장염이 의심되면 이 약의 투여를 중단해야 하며, 급성 췌장염이 확진되면 이 약 투여를 다시 시작하지 말아야 한다 .
(변경 근거) 3년간 진행된 삭센다 장기 임상 SCALE™(Satiety and Clinical Adiposity-Liraglutide Evidence) 연구 결과에 근거
D. 【사용상의 주의사항】 3. (7) 내용 중
(문구 삭제) 임상시험에서 심장 및 뇌혈관 질환 환자에서의 노출이 제한적이었기 때문에, 특히 이러한 환자에 대해 이 약의 투여에서 나타난 심박수 상승의 임상적 중요성은 분명하지 않다.
(변경 근거) LEADER™ (Liraglutide Effect and Action in Diabetes: Evaluation of cardiovascular outcome Results)1
; 리라글루티드의 심혈관 질환 발생에 대한 임상시험으로서 일차 평가 기준은 FDA 지침에 따른 주요 심혈관 사건(CV 사망, 비 치명적 심근 경색 (심장 발작, 비치명적 뇌졸중)의 최초 발생에 이르기까지의 시간. LEADER™ 임상은 CV 위험이 높은 제 2 형 당뇨병 환자 9340 명에게 리라글루티드 1.8mg의 5년 장기효과를 평가함.
▶ 참고) SCALE™ 임상 소개
SCALE™(Satiety and Clinical Adiposity-Liraglutide Evidence)은 삭센다®를 평가하기 위해 제3a상, 다국가 5,358명의 환자들을 대상으로 무작위배정, 이중눈가림, 위약 대비, 4가지 연구로 구성된 대규모 임상 시험이다. 삭센다®는 SCALE™ 임상을 통해 체중 감소 및 체중 감소 유지 효과를 입증 받았다. 특히 비만 및 당뇨병 전단계 환자 3731명을 대상으로 진행한 임상 연구 결과에서는 삭센다® 투여 군의 체중이 지속적으로 감소해 1년 후 투약 완료군에서 체중의 9.2%가 감소한 것으로 나타났다. 또한 삭센다®는 비만 약제 중 유일하게 심대사 위험요인(혈당, 혈압, 혈중 지질 등)을 개선했을 뿐만 아니라 당뇨병 전단계에 있어서도 체중 감소 및 혈당 개선 효과를 입증한 바 있다.
▶ 삭센다 소개
삭센다®는 세계 최초이자 유일한 GLP-1 유사체 비만 치료 신약으로 음식 섭취에 반응하여 자연적으로 분비되는 인체 내 식욕 조절 물질인 GLP-1과 97%가량 유사해, 포만감을 높임으로써 식욕을 조절하고 공복감과 음식 섭취를 줄여 체중을 감소시킨다. 총 5,358명의 환자 대상 4가지 연구로 구성된 대규모 SCALE™(Satiety and Clinical Adiposity – Liraglutide Evidence) 임상시험 을 통해 유의미한 체중 감소 효과뿐 아니라, 체중 감량 유지 효과를 입증 받았다.2,3 특히 비만 치료제 중 유일하게 심대사 위험요인(혈당, 혈압, 혈중 지질 등)을 개선하였으며, 당뇨병 전단계 환자에 있어서도 체중 감소 및 혈당 개선 효과를 입증한 바 있다.5,6,7,8,9 아시아에서는 한국에서 최초로 지난 3월 16일 출시되었다.
References
1 Marso SP et al. N Engl J Med 2016;375(4):311-322
2 Greenway F, et al. Additional analyses of the weight-lowering efficacy of liraglutide 3.0 mg in overweight and
obese adults: the SCALE Obesity and Prediabetes randomized trial. Obesity Week 2014. Oral presentation T-3027-OR.
3 Wadden TA, et al. Int J Obes (Lond) 2013;37:1443–1451.
4 Pi-Sunyer et al. N Engl J Med. 2015;373(1):11-22.
5 Krempf et al. Diabetologia 2014; 57(Suppl. 1): Abstract 903-P
6 Bode et al. Diabetologia 2014; 57 (Suppl 1): Abstract 181-OR
7 Pi-Sunyer X, et al. Diabetologia 2014; 57(Suppl. 1): Abstract 73-OR
8 Davies M, et al. Diabetologia 2014; 57 (Suppl 1): Abstract 39-OR
9 Pi-Sunyer et al. N Engl J Med 2015;373:11–22
10 Unger J. Liraglutide: can it make a difference in the treatment of type 2 diabetes?Int J Clin Pract Suppl. 2010:1-3.
11 Orskov C, Wettergren A, Holst JJ. Secretion of the incretin hormones glucagonlike peptide-1 and gastric inhibitory polypeptide correlates with insulin secretion in normal man throughout the day. Scandinavian Journal of Gastroenterology. 1996; 31:665-670.
12 Knudsen LB, Nielsen PF, Huusfeldt PO, et al. Potent derivatives of glucagon-like peptide-1 with pharmacokinetic properties suitable for once daily administration. Journal of Medicinal Chemistry. 2000; 43:1664-1669.
13 Secher A, Jelsing J, Baquero AF, et al. The arcuate nucleus mediates GLP-1 receptor agonist liraglutide-dependent weight loss. J Clin Invest. 2014; 124:4473- 4488.
14 van Can J, Sloth B, Jensen CB, et al. Effects of the once-daily GLP-1 analog liraglutide on gastric emptying, glycemic parameters, appetite and energy metabolism in obese, non-diabetic adults. International Journal of Obesity. 2014; 38:784-793.
Drugs/EndocrinologicandMetabolicDrugsAdvisoryCommittee/ucm413316.htm (Last accessed: 6 March 2015).